Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Lý thuyết SVIP
I. KIẾN THỨC CẦN NHỚ
1. Cấu tạo của kim loại
a. Cấu tạo nguyên tử
- Các nguyên tử của các nguyên tố kim loại hầu hết đều có từ 1, 2 hoặc 3 electron ở lớp ngoài cùng.
b. Cấu tạo tinh thể
- Trong tinh thể kim loại, nguyên tử và ion kim loại nằm ở những nút của mạng tinh thể. Các electron hóa trị chuyển động tự do trong mạng tinh thể.
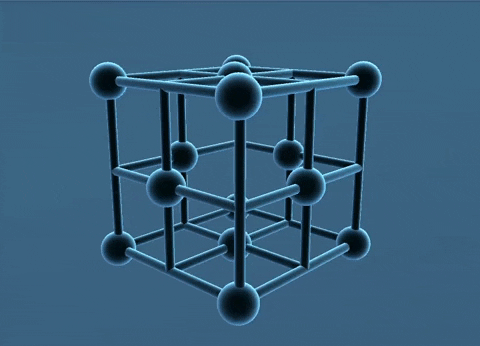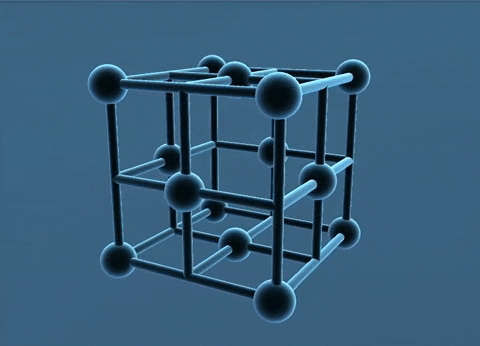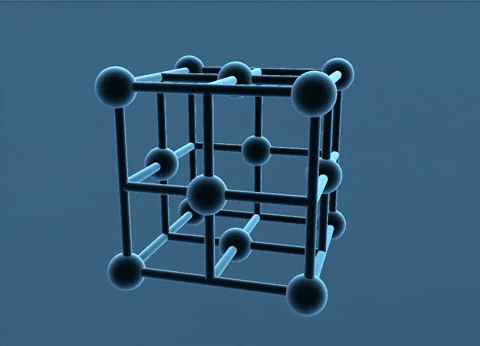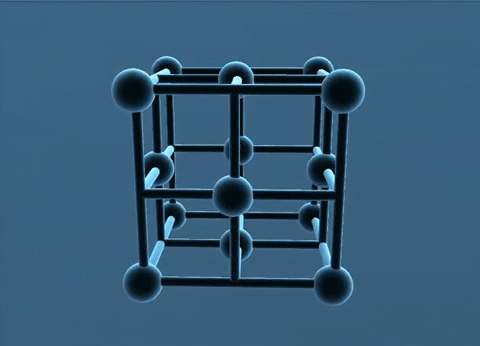

Mạng tinh thể lập phương tâm diện và tâm khối.
c. Liên kết kim loại
- Liên kết kim loại là liên kết được hình thành giữa các nguyên tử và ion kim loại trong mạng tinh thể do sự tham gia của các electron tự do.

2. Tính chất của kim loại
a. Tính chất vật lí chung
- Những tính chất vật lí chung của kim loại bao gồm tính dẻo, dẫn điện, dẫn nhiệt, có ánh kim và là do các electron tự do trong kim loại gây ra.
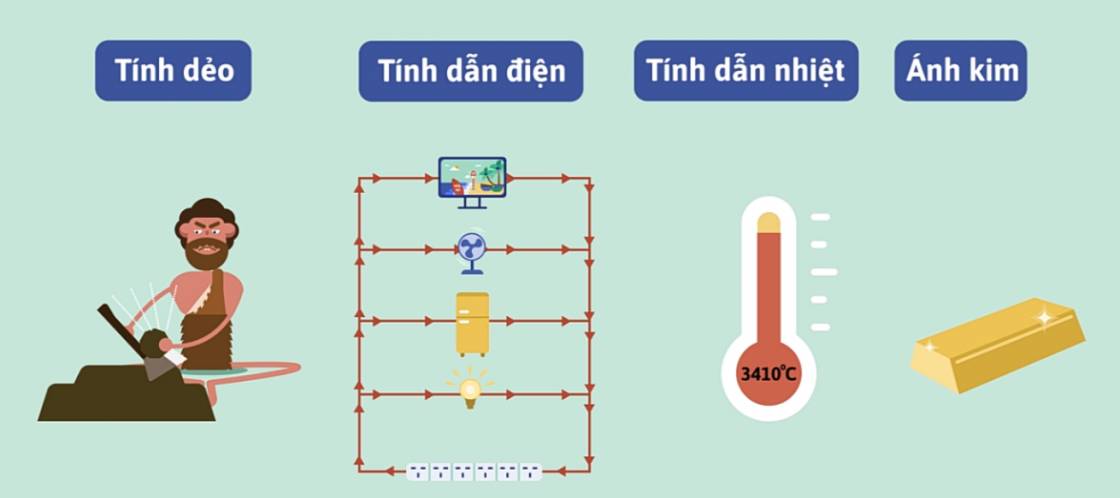
b. Tính chất hóa học chung
- Các kim loại đều có tính khử: M ➜ Mn+ + ne
- Nguyên nhân: Các electron hóa trị của kim loại liên kết yếu với hạt nhân nguyên tử, do đó các nguyên tử kim loại dễ dàng nhường đi các electron hóa trị này để tạo thành ion dương.
c. Dãy điện hóa của kim loại
- Dãy điện hóa của kim loại cho phép dự đoán chiều phản ứng giữa 2 cặp oxi hóa - khử theo quy tắc α.
- Chất oxi hóa mạnh hơn sẽ oxi hóa chất khử mạnh hơn tạo thành chất oxi hóa yếu hơn và chất khử yếu hơn.
- Ví dụ: \(\dfrac{Cu^{2+}}{Cu}\), \(\dfrac{Ag^+}{Ag}\)
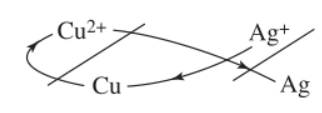
2Ag+ + Cu ➜ Cu2+ + 2Ag
II. BÀI TẬP
Bài 1. Cho 1,7 gam hỗn hợp gồm Zn và kim loại X thuộc nhóm IIA tác dụng với dung dịch HCl dư, sinh ra 0,672 lít khí H2 ở đktc. Mặt khác, khi cho 1,9 gam X tác dụng với dung dịch H2SO4 loãng, dư thì thể tích khí H2 sinh ra chưa đến 1,12 lít (đktc). Xác định kim loại X.
Hướng dẫn giải
- M + 2H+ ➜ M2+ + H2 (M = Zn, X)
=> M = \(\dfrac{1,7}{0,03}\) = 56,67 => X < 56,67 < Zn (65) (1)
- X + 2H+ ➜ X2+ + H2
=> X > \(\dfrac{1,9}{0,05}\) = 38 (2)
(1), (2) => 38 < X < 56,67
- X thuộc nhóm IIA => X là Ca (40).
Bài 2. Cho 13,5 gam hỗn hợp (Al, Cr, Fe, Mg) tác dụng với lượng dư dung dịch H2SO4 loãng, nóng thu được dung dịch X và 7,84 lít khí H2 (đktc). Cô cạn dung dịch X thu được m gam muối khan. Xác định giá trị của m.
Hướng dẫn giải
Coi 4 kim loại đã cho là M:
2M + nH2SO4 ➜ M2(SO4)n + nH2
Ta thấy nH2SO4 = nH2 = 0,35.
Áp dụng định luật bảo toàn khối lượng ta có: m = 13,5 + 98.0,35 - 2.0,35 = 47,1 gam.
Bài 3. Ngâm một đinh sắt trong 200ml dung dịch CuSO4 x M. Sau khi phản ứng kết thúc lấy đinh sắt ra khỏi dung dịch rửa nhẹ, làm khô thấy khối lượng đinh sắt tăng 1,6 gam. Giá trị của x bằng bao nhiêu?
Hướng dẫn giải
Gọi số mol CuSO4 tham gia phản ứng là a mol.
Fe + CuSO4 ➜ FeSO4 + Cu
a a a
Theo đề bài ta có: mtăng = mCu - mFe phản ứng
=> 1,6 = 64a - 56a <=> a = 0,2
=> [CuSO4] = \(\dfrac{0,2}{0,2}\) = 1M
Bài 4. Hỗn hợp bột gồm 3 kim loại Mg, Al, Zn có khối lượng 7,18 gam được chia làm hai phần đều nhau. Phần 1 đem đốt cháy hoàn toàn trong oxi dư thu được 8,71 gam hỗn hợp oxit. Phần 2 hòa tan hoàn toàn trong HNO3 đặc nóng dư thu được V lít (đktc) khí NO2 (sản phẩm khử duy nhất). Hãy tính giá trị của V.
Hướng dẫn giải
Áp dụng định luật bảo toàn khối lượng với phần 1 ta có:
mO2 = 8,71 - \(\dfrac{7,18}{2}\) = 5,12 gam
=> nO2 = \(\dfrac{5,12}{32}\) = 0,16 mol
Do khối lượng kim loại ở 2 phần là bằng nhau nên số mol do hỗn hợp kim loại nhường là như nhau => số mol electron do O2 nhận bằng số mol do N+5 nhận.
| O2 + 4e ➜ 2O2- | N+5 + e ➜ N+4 |
| 0,16 ➜ 0,64 | 0,64 ➜ 0,64 |
=> V = 0,64.22,4 = 14,336 lít.
Trong quá trình học tập, nếu có bất kỳ thắc mắc nào, các em hãy để lại câu hỏi ở mục hỏi đáp để cùng thảo luận và trả lời nhé. Chúc các em học tốt!

Bạn có thể đánh giá bài học này ở đây