Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Khái niệm về cân bằng hóa học SVIP
I. Phản ứng một chiều, phản ứng thuận nghịch và cân bằng hóa học
1. Khái niệm phản ứng một chiều
Trong điều kiện xác định, phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không phản ứng được với nhau để tạo thành chất đầu được gọi là phản ứng một chiều.
Phương trình hoá học của phản ứng một chiều được biểu diễn bằng một mũi tên (→) chỉ chiều phản ứng.
Ví dụ 1:
\(KMnO_4\overset{t^o}{\rightarrow}KMnO_4+MnO_2+O_2\uparrow\)
2. Khái niệm phản ứng thuận nghịch
Phản ứng thuận nghịch là phản ứng xảy ra theo hai chiều ngược nhau trong cùng điều kiện.
Phương trình hóa học của phản ứng thuận nghịch được biểu diễn bằng hai nửa mũi tên ngược chiều nhau. Chiều từ trái sang phải là chiều phản ứng thuận, chiều từ phải sang trái là chiều phản ứng nghịch.
Ví dụ 2:
\(Cl_2\left(g\right)+H_2O⇌HCl\left(aq\right)+HClO\left(aq\right)\)
3. Khái niệm trạng thái cân bằng của phản ứng thuận nghịch
Ví dụ 3: Cho phản ứng thuận nghịch sau:
\(N_2\left(g\right)+3H_2\left(g\right)\overset{t^o,xt,p}{⇌}2NH_3\left(g\right)\)
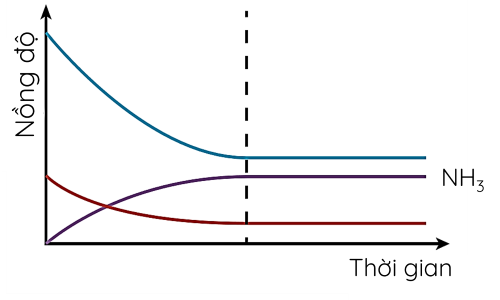
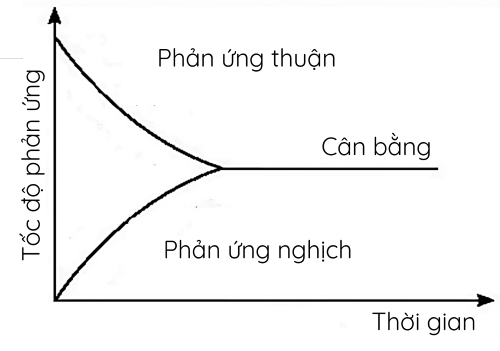
Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.
II. Hằng số cân bằng
Xét phản ứng thuận nghịch tổng quát:
aA + bB ⇌ cC + dD
Ở trạng thái cân bằng, hằng số cân bằng (\(K_C\)) của phản ứng được xác định theo biểu thức:
\(K_C=\dfrac{\left[C\right]^c\left[D\right]^d}{\left[A\right]^a\left[B\right]^b}\)
Trong đó: \(\left[A\right],\left[B\right],\left[C\right],\left[D\right]\) là nồng độ mol của các chất A, B, C, D ở trạng thái cân bằng; a, b, c, d là hệ số tỉ lượng của các chất trong phương trình hoá học của phản ứng. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng.
Hằng số cân bằng của một phản ứng thuận nghịch chỉ phụ thuộc vào nhiệt độ và bản chất của phản ứng.
Ví dụ 3: Trong phản ứng thuận nghịch: H2 (g) + I2 (g) ⇌ 2HI (g), hằng số cân bằng được viết bằng biểu thức sau:
\(K_C=\dfrac{\left[HI\right]^2}{\left[H_2\right]\left[I_2\right]}\)
Hằng số cân bằng Kc là một đại lượng có ý nghĩa quan trọng, nó cho biết mức độ xảy ra của phản ứng.
III. Sự chuyển dịch cân bằng hóa học
Thí nghiệm: Ảnh hưởng của nhiệt độ tới chuyển dịch cân bằng hóa học
Bước 1: Cho khoảng 10 gam CH3COONa và 50 mL nước cất vào bình tam giác. Thêm vài giọt dung dịch phenolphthalein vào lắc đều.
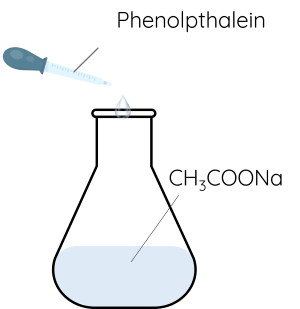
Bước 2: Đun nóng nhẹ bình tam giác.

Trong thí nghiệm trên xảy ra sự chuyển dịch cân bằng của phản ứng thủy phân sodium acetate:
\(CH_3COONa\left(aq\right)+H_2O\left(l\right)⇌CH_3COOH\left(aq\right)+NaOH\left(aq\right)\)
Sự chuyển dịch cân bằng hóa học là sự chuyển dịch từ trạng thái cân bằng này sang trạng thái cân bằng khác.
IV. Các yếu tố ảnh hưởng đến sự chuyển dịch cân bằng hoá học
Những yếu tố làm ảnh hưởng đến chuyển dịch cân bằng thường là nồng độ, áp suất và nhiệt độ.
Nguyên lí chuyển dịch cân bằng Le Chatelier:
"Một phản ứng thuận nghịch đang ở trạng thái cân bằng, khi chịu một tác động bên ngoài làm thay đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều làm giảm tác động bên ngoài đó."
1. Ảnh hưởng của nhiệt độ đến cân bằng hóa học
Ví dụ 4: Xét phản ứng:
| \(2NO_2\left(g\right)⇌N_2O_4\left(g\right)\) | \(\Delta_rH^0_{298}=-58\left(kJ\right)\) |
Khi hỗn hợp khí trên đang ở trạng thái cân bằng, nếu ngâm bình vào nước nóng, màu nâu đỏ sẽ đậm lên (NO2). Nếu làm lạnh bình bằng nước đá thì màu của hỗn hợp sẽ nhạt đi (N2O4).
- Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều của phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ.
- Khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều tỏa nhiệt, nghĩa là chiều làm giảm tác động của việc giảm nhiệt độ.
2. Ảnh hưởng của áp suất đến cân bằng hóa học
Ví dụ 4: Xét phản ứng:
| \(2NO_2\left(g\right)⇌N_2O_4\left(g\right)\) | \(K_C=\dfrac{\left[N_2O_4\right]}{\left[NO_2\right]^2}\) |
Khi thực hiện phản ứng này trong xilanh kín có pit-tông ở nhiệt độ không đổi. Khi hệ đạt trạng thái cân bằng, nếu tăng áp suất của hệ bằng cách đẩy pit-tông thì màu nâu đỏ sẽ nhạt dần (cân bằng chuyển dịch theo chiều thuận). Nếu giảm áp suất của hệ bằng cách kéo pit-tông ra, màu nâu sẽ đậm dần (cân bằng chuyển dịch theo chiều nghịch).
- Khi tăng hệ đang ở trạng thái cân bằng, nếu tăng hoặc giảm áp suất của hệ, cân bằng chuyển dịch theo chiều làm giảm hoặc tăng áp suất của hệ.
- Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khi ở hai vế của phương trình hóa học bằng nhau hoặc hệ không có chất khí, việc tăng hoặc giảm áp suất không làm chuyển dịch cân bằng của hệ.
3. Ảnh hưởng của nồng độ đến cân bằng hóa học
Ví dụ 5: Xét hệ cân bằng sau trong bình kín ở nhiệt độ cao không đổi:
| \(C\left(s\right)+CO_2\left(g\right)⇌2CO_2\left(g\right)\) | \(K_C=\dfrac{\left[CO\right]^2}{\left[CO_2\right]}\) |
Khi thổi thêm khí CO2 vào hệ, nồng độ khí CO2 tăng lên, làm cân bằng thay đổi. Ở nhiệt độ xác định với KC không đổi, do đó lượng CO2 phải giảm bớt, lượng CO tăng lên, cân bằng chuyển dịch theo chiều thuận cho đến khi đạt trạng thái cân bằng mới. Hiện tượng xảy ra tương tự nếu giảm nồng độ khí CO.
Nếu trong hệ có chất rắn thì việc thêm bớt chất rắn hầu như không ảnh hưởng đến trạng thái cân bằng của hệ.
- Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ chất đó, nghĩa là cân bằng sẽ chuyển dịch tương ứng theo theo chiều làm giảm hoặc tăng nồng độ chất đó.
1. Trong điều kiện xác định, phản ứng chỉ xảy ra theo chiều từ chất tham gia tạo thành sản phẩm mà sản phẩm không thể tác dụng với nhau để tạo lại chất ban đầu, gọi là phản ứng một chiều. Trong phương trình hóa học của phản ứng một chiều, người ta dùng kí hiệu mũi tên (→) chỉ chiều phản ứng.
2. Trong điều kiện xác định, phản ứng xảy ra theo hai chiều trái ngược nhau trong cùng điều kiện gọi là phản ứng thuận nghịch. Trong phường trình hóa học của phản ứng thuận nghịch người ta dùng kí hiệu hai nửa mũi tên ngược chiều (⇌): chiều từ trái sang phải là chiều thuận, chiều từ phải sang trái là chiều nghịch.
3. Trạng thái cân bằng của phản ứng thuận nghịch là trạng thái mà tại đó tốc độ phản ứng thuận bằng tốc độ phản ứng nghịch.4. Nếu có phản ứng thuận nghịch sau:
aA + bB ⇌ cC + dD
Khi phản ứng ở trạng thái cân bằng, ta có:
\(K_C=\dfrac{\left[C\right]^c\left[D\right]^d}{\left[A\right]^a\left[B\right]^b}\)
Trong đó [A], [B], [C] và [D] là nồng độ mol các chất A, B, C và D ở trạng thái cân bằng; a, b, c và d là hệ số tỉ lượng các chất trong phương trình hóa học. Chất rắn không xuất hiện trong biểu thức hằng số cân bằng. Trong phản ứng thuận nghịch, hằng số cân bằng Kc của phản ứng xác định chỉ phụ thuộc và nhiệt độ.
5. Sự chuyển dịch cân bằng hóa học là sự chuyển dịch từ trạng thái cân bằng này sang trạng thái cân bằng khác.
6. Khi tăng nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng thu nhiệt, nghĩa là chiều làm giảm tác động của việc tăng nhiệt độ. Ngược lại, khi giảm nhiệt độ, cân bằng chuyển dịch theo chiều phản ứng tỏa nhiệt, chiều làm giảm tác động của việc giảm nhiệt độ.
7. Khi hệ đạng ở trạng thái cân bằng, nếu tăng hoặc giảm áp suất của hệ cân bằng chuyển dịch theo chiều làm giảm hoặc tăng áp suất của hệ. Khi hệ cân bằng có tổng hệ số tỉ lượng của các chất khí ở hai vế của phương trình hóa học bằng nhau hoặc trong hệ thông có chất khí, việc tăng hoặc giảm áp xuất không làm chuyển dịch cân bằng của hệ.
8. Khi tăng hoặc giảm nồng độ một chất trong cân bằng thì cân bằng chuyển dịch theo chiều làm giảm tác động của việc tăng hoặc giảm nồng độ của chất đó, nghĩa là cân bằng sẽ chuyển dịch tương ứng theo chiều làm giảm hoặc tăng nồng độ của chất đó.
Bạn có thể đăng câu hỏi về bài học này ở đây
