Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Hạt nhân và mô hình nguyên tử SVIP
1. GIỚI THIỆU VỀ THÍ NGHIỆM TÁN XẠ HẠT ALPHA
➤ Thí nghiệm tán xạ hạt alpha
Năm 1897, nhà vật lí Joseph John Thompson đã phát hiện sự tồn tại của các electron mang điện âm trong nguyên tử dựa trên những nghiên cứu về tia âm cực (tia cathode). Sau đó, ông đã đề xuất một mô hình cấu tạo nguyên tử gồm phần điện tích dương phân bố đều trong một không gian hình cầu đặc và các electron được phân bố trong hình cầu đó.
Thí nghiệm Rutherford - khám phá cấu tạo nguyên tử vàng
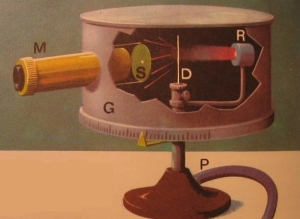
Trong thí nghiệm này, Rutherford sử dụng chùm hạt alpha mang điện tích dương (kí hiệu α, chính là hạt nhân nguyên tử He).
Chùm hạt này được phát ra từ nguồn R bắn vào lá vàng D rất mỏng (độ dày chỉ khoảng 4.10-7 m được đặt trong hộp chân không G. Ông sử dụng kính hiển vi M để quan sát các đốm sáng phát ra khi hạt này đập vào kính S có phủ chất huỳnh quang.
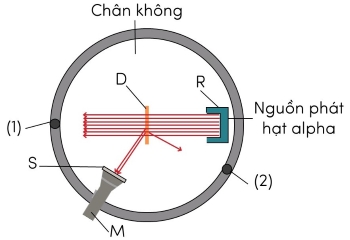
Khi di chuyển kính hiển vi từ vị trí (1) đến vị trí (2), tần suất đốm sáng xuất hiện trên màn S giảm đi rất nhanh. Tại vị trí (2) vẫn thấy xuất hiện các đốm sáng nhưng tần suất ít hơn so với vị trí (1) cỡ 104 lần.
Kết quả:
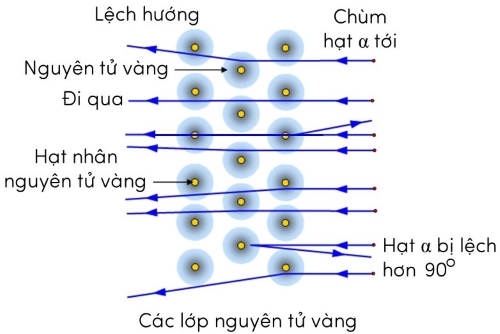
Hiện tượng lệch hướng chuyển động của hạt alpha khi đến gần hạt nhân vàng gọi là hiện tượng tán xạ hạt alpha.
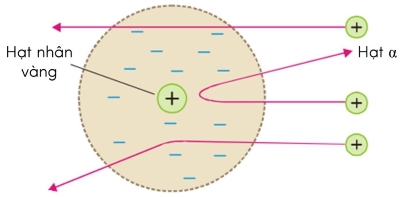
➤ Mô hình đơn giản của nguyên tử
Những kết quả từ thí nghiệm tán xạ hạt alpha đã phủ định mô hình nguyên tử của Thompson và ủng hộ mô hình nguyên tử của Rutherford:
- Nguyên tử có cấu trúc rỗng với hạt nhân nằm ở tâm của nguyên tử. Khối lượng của hạt nhân xấp xỉ bằng khối lượng của nguyên tử, điện tích của hạt nhân có giá trị dương (bằng tổng điện tích các hạt proton).
- Các electrong phân bố trong không gian trống xung quanh hạt nhân và chuyển động trong các quỹ đạo khép kín quanh hạt nhân.
Tuy nhiên, mô hình nguyên tử của Rutherford còn có hạn chế: Theo lí thuyết trường điện từ, một hạt mang điện chuyển động có gia tốc sẽ phát ra năng lượng. Do đó, khi electron chuyển động trên quỹ đạo tròn sẽ mất năng lượng, tốc độ của electron sẽ giảm dần và cuối cùng rơi vào hạt nhân. Điều này dẫn đến nguyên tử bị phá hủy và vật chất không thể tồn tại trong vũ trụ.
Năm 1913, nhà vật lí Niels Bohr đã bổ sung 2 tiên đề vào mô hình nguyên tử của Rutherford để giải quyết hạn chế trên: Nguyên tử chỉ tồn tại trong các trạng thái có năng lượng xác định, gọi là các trạng thái dừng. Khi ở trạng thái dừng, nguyên tử không phát xạ.
2. HẠT NHÂN CỦA NGUYÊN TỬ
➤ Cấu tạo hạt nhân
Hạt nhân được tạo thành bởi hai loại hạt là proton và neutron, hai loại hạt này có tên chung là nucleon.
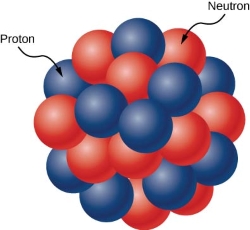
- Proton (kí hiệu p), có khối lượng mp \(\approx\) 1,67262.10-27 kg, điện tích là q = +e \(\approx\) 1,6.10-19 C.
- Neutron (kí hiệu n), có khối lượng mn \(\approx\) 1,67493.10-27 kg, trung hòa về điện.
Khối lượng nguyên tử bằng tổng khối lượng hạt nhân và electron có trong nguyên tử. Hạt nhân có khối lượng rất lớn so với khối lượng của các electron, vì vậy khối lượng nguyên tử gần như tập trung toàn bộ ở hạt nhân.
Số proton trong hạt nhân bằng Z. Tổng số nucleon trong một hạt nhân được kí hiệu là A; A gọi là số khối.
➤ Kí hiệu hạt nhân
Người ta dùng kí hiệu hóa học X của nguyên tố để kí hiệu cho hạt nhân, kèm theo hai số Z và A như sau: \(_Z^AX.\)
Ví dụ: hạt nhân carbon có 12 nucleon trong đó có 6 proton được kí hiệu \(_6^{12}C\).
➤ Đồng vị
Các hạt nhân đồng vị là những hạt nhân có cùng số Z, khác số A, nghĩa là cùng số proton và khác số neutron.
Các đồng vị được chia làm hai loại: đồng vị bền và đồng vị phóng xạ (không bền). Hầu hết các mẫu chất trong tự nhiên đều là hỗn hợp của nhiều đồng vị.
Ví dụ: Carbon có ba đồng vị chính là \(_6^{12}C,\) \(_6^{13}C,\) \(_6^{14}C\). Trong đó đồng vị \(_6^{12}C\) và \(_6^{13}C\) là đồng vị bền chiếm hơn 99 % carbon tự nhiên.
➤ Kích thước hạt nhân
Có thể coi hạt nhân nguyên tử như một quả cầu bán kính $R$; $R$ phụ thuộc vào tổng số hạt nucleon $A$ theo công thức gần đúng:
$R=1,2.10^{-15}.A^{\frac{1}{3}}$ (m)
| Tên nguyên tố | Số khối |
Bán kính nguyên tử 10-10 m |
Bán kính hạt nhân 10-15 m |
| Hydrogen | 1 | 1,2 | 0,9 |
| Helium | 4 | 1,4 | 1,7 |
| Oxigen | 16 | 1,5 | 2,7 |
| Silicon | 28 | 2,1 | 3,1 |
| Sắt | 56 | 1,9 | 3,7 |
| Cadimium | 114 | 1,6 | 4,6 |
| Vàng | 197 | 1,7 | 5,4 |
| Uranium | 238 | 1,9 | 5,9 |
1. Phần lớn không gian bên trong nguyên tử là rỗng, toàn bộ điện tích dương trong nguyên tử chỉ tập trung tại một vùng có bán kính rất nhỏ nằm ở tâm của nguyên tử, được gọi là hạt nhân của nguyên tử.
2. Số proton trong hạt nhân $Z$ là số hiệu nguyên tử, bằng số thứ tự của nguyên tố đang xét trong Bảng tuần hoàn các nguyên tố hóa học.
Tổng số các nucleon trong hạt nhân được gọi là số khối: $A=Z+N$ với $N$ là số neutron trong hạt nhân.
3. Hạt nhân của nguyên tử tương ứng với nguyên tố có kí hiệu hóa học $X$ được kí hiệu là \(_Z^AX\).
4. Đồng vị là những nguyên tử mà hạt nhân chứa cùng số proton $Z$, nhưng có số neutron $N$ khác nhau.

Bạn có thể đánh giá bài học này ở đây