Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Điện phân SVIP
I. Điện phân nóng chảy, điện phân dung dịch
Điện phân là quá trình oxi hóa – khử xảy ra tại các điện cực khi có dòng điện một chiều với hiệu điện thế đủ lớn đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
Nguyên tắc điện phân nóng chảy
- Tại cathode (điện cực âm): xảy ra quá trình khử ion dương.
- Tại anode (điện cực dương): xảy ra quá trình oxi hóa ion âm.
Ví dụ 1: Sodium chloride (NaCl) nóng chảy điện li thành các ion Na+ và Cl- chuyển động tự do. Trong điện trường, các ion này sẽ di chuyển về các điện cực trái dấu. Ở một hiệu điện thế đủ lớn, trên bề mặt các điện cực xảy ra các quá trình:
+ Cực âm (cathode): quá trình khử ion Na+
Na+ + e → Na
+ Cực dương (anode): quá trình oxi hóa Cl-
2Cl- → Cl2 + 2e
⇒ Phương trình hóa học của phản ứng điện phân NaCl nóng chảy:
2NaCl(l) → 2Na(s) + Cl2(g)
Nguyên tắc điện phân dung dịch
- Ở cathode, ưu tiên điện phân chất có tính oxi hóa mạnh hơn; ở anode, ưu tiên điện phân chất có tính khử mạnh hơn.
Ví dụ 2:
+ Thứ tự điện phân tại anode: I- > Br- > Cl- (các anion nhứ CO32-, NO3-, PO43-, SO42-, F- và ClO4- coi như không bị điện phân).
+ Thứ tự điện phân tại cathode: Au3+ > Ag+ > Hg2+ > Cu2+ > H+ > H2O
- Khi điện phân dung dịch, nước cũng có thể tham gia điện phân với vai trò chất khử (2H2O → O2 + 4H+ + 4e) hoặc chất oxi hóa (2H2O + 2e → H2 + 2OH-).
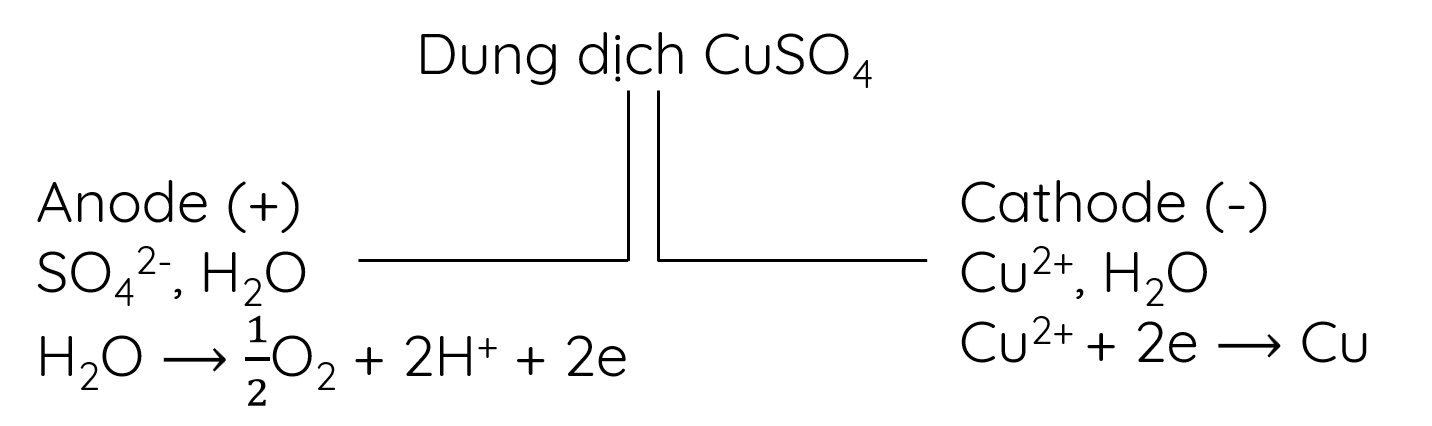
Ví dụ 3: Điện phân dung dịch CuSO4 với điện cực graphite (than chì)
+ Ở anode có thể xảy ra sự oxi hóa ion SO42- hoặc phân tử H2O. Tuy nhiên, vì H2O dễ bị oxi hóa hơn SO42- nên H2O bị oxi hóa trước, tạo thành sản phẩm là khí O2.
2H2O → O2 + 4H+ + 4e
+ Ở cathode có thể xảy ra sự khử ion Cu2+ hoặc phân tử H2O. Vì ion Cu2+ dễ bị khử hơn H2O nên ion Cu2+ bị khử trước, tạo thành kim loại Cu bám trên cathode.
Cu2+ + 2e → Cu
- Sơ đồ điện phân:
Ví dụ 4: Điện phân dung dịch NaCl với các điện cực trơ
Dung dịch thu được khi điện phân dung dịch NaCl là nước Javel, có tính tẩy màu.
II. Ứng dụng
Điện phân có nhiều ứng dụng quan trọng trong thực tiễn như sản xuất kim loại mạnh (Na, Al,...), mạ điện, tinh chế kim loại,...
Ví dụ 5: Sản xuất Al bằng phương pháp điện phân
Trong công nghiệp, nhôm được sản xuất từ quặng bauxite theo hai giai đoạn chính:
-
Giai đoạn 1: Tinh chế quặng bauxite bằng phương pháp hóa học thu được Al2O3.
-
Giai đoạn 2: Điện phân Al2O3 nóng chảy. Do Al2O3 có nhiệt độ nóng chảy rất cao (2050 oC) nên Al2O3 được trộn cùng với cryolite (Na3AlF6) để tạo thành hỗn hợp nóng chảy ở nhiệt độ gần 1000 oC giúp tiết kiệm năng lượng, đồng thời tạo ra chất lỏng có tính dẫn điện tốt, nổi lên trên Al lỏng để năng cách Al lỏng với không khí.
Thùng điện phân có cathode là tấm than chì ở dưới đáy thùng, anode là những tấm than chì có thể di chuyển theo phương thẳng đứng.
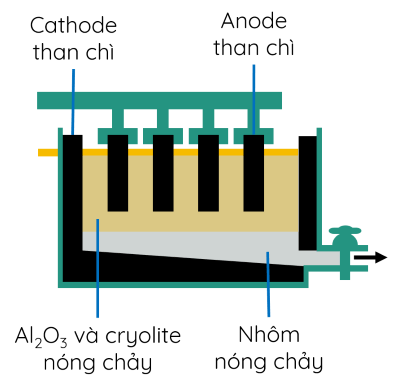
Khí O2 tạo thành ở nhiệt độ cao, đốt cháy dần điện cực anode than chì thành CO và CO2. Do vậy, trong quá trình điện phân phải hạ thấp dần các điện cực anode vào thùng điện phân.
Ví dụ 6: Mạ điện bằng phương pháp điện phân
- Phương pháp điện phân được sử dụng trong mạ điện, trong đó ion kim loại bị khử, tạo thành lớp kim loại rắn bao phủ trên bề mặt kim loại cần mạ nhằm trang trí bề mặt hoặc chống sự ăn mòn.
- Trong kĩ thuật mạ điện, các kim loại mạ thường là chromium, nickel, đồng, vàng, bạc, platinum,...
- Bình mạ điện chứa dung dịch muối của kim loại mạ, vật cần mạ và thanh kim loại mạ.
Quá trình điện phân để mạ đồng lên một chiếc chìa khóa được mô tả trong hình sau.
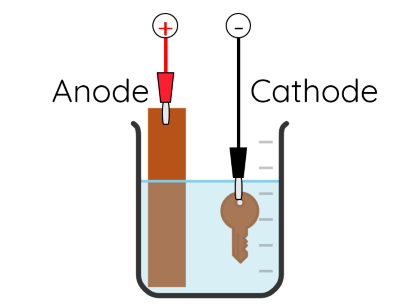
Trong quá trình điện phân, thanh kim loại đóng vai trò là anode, chiếc chìa khóa đóng vai trò là cathode và dung dịch điện phân là dung dịch CuSO4. Các quá trình xảy ra ở các điện cực tương tự như quá trình điện phân tinh chế đồng với anode tan. Độ dày của lớp mạ tỉ lệ thuận với cường độ dòng điện chạy qua dung dịch điện phân và thời gian mạ.
Ví dụ 7: Tinh luyện đồng bằng phương pháp điện phân
Trong công nghiệp, đồng phế liệu hoặc đồng thô được tinh chế bằng phương pháp điện phân. Bình điện phân tinh chế đồng chức dung dịch muối CuSO4 trong dung dịch H2SO4, anode bằng đồng thô và cathode là đồng tinh khiết.
Tại anode: Cu bị oxi hóa thành ion Cu2+ đi vào dung dịch
Cu → Cu2+ + 2e
Tại cathode: Cu2+ bị thử thành Cu bám trên cathode:
Cu2+ + 2e → Cu
Quá trình điện phân này được coi như là sự chuyển dời kim loại Cu từ anode về cathode. Kết thúc quá trình điện phân thu được đồng tinh khiết ở cathode.
1. Điện phân là quá trình oxi hóa – khử xảy ra trên bề mặt các điện cực khi có dòng điện một chiều đi qua chất điện li nóng chảy hoặc dung dịch chất điện li.
2. Thứ tự điện phân:
- Tại anode: chất khử mạnh hơn bị oxi hóa trước.
- Tại cathode: chất oxi hóa yếu mạnh hơn bị khử trước.
3. Điện phân có nhiều ứng dụng quan trọng trong thực tiễn như: sản xuất kim loại mạnh (Na, Al,...), mạ điện, tinh chế kim loại,...

Bạn có thể đánh giá bài học này ở đây