Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Đề thi cuối học kì 1 (đề số 3) SVIP
Yêu cầu đăng nhập!
Bạn chưa đăng nhập. Hãy đăng nhập để làm bài thi tại đây!
Lớp vỏ nguyên tử được tạo thành từ các hạt
Liên kết sigma (σ) không được hình thành từ sự xen phủ
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số
Kí hiệu phân lớp nào sau đây sai?
Phân tử nào dưới đây có liên kết cộng hóa trị không phân cực?
Trong bảng tuần hoàn các nguyên tố hóa học, nhóm VIIIA gồm các nguyên tố
Nguyên tử kim loại nào sau đây có xu hướng nhường electron để đạt được cấu hình electron của khí hiếm Ne (Z = 10)?
Liên kết ion được hình thành do lực hút tĩnh điện giữa
Nguyên tố R có cấu hình electron nguyên tử là 1s22s22p3. Vị trí của nguyên tố R trong bảng tuần hoàn là
Chất nào dưới đây tạo được liên kết hydrogen giữa các phân tử?
Trong một chu kì, theo chiều tăng dần điện tích hạt nhân, bán kính nguyên tử và độ âm điện
Vôi sống là chất rắn có dạng tinh thể màu trắng, ăn da và có tính kiềm. Thành phần chính của vôi sống là CaO. Trong phân tử CaO có chứa liên kết
Trong phân tử C2H4 (H2C=CH2), số liên kết sigma (σ) và liên kết pi (π) lần lượt là
Nguyên tố X phổ biến trong tự nhiên và chất cần thiết để tạo ra phần lớn các loại hình sự sống. X nằm ở nhóm VIIA trong bảng tuần hoàn. Công thức oxide ứng với hóa trị cao nhất của X là
Sử dụng thông tin sau cho Câu 1 và Câu 2: Phosphorus là nguyên tố thiết yếu cho các cơ thể sống và có nhiều ứng dụng trong đời sống như sản xuất phân bón, chế tạo các vật liệu nổ, pháo hoa,... Trong nguyên tử phosphorus có 46 hạt, số hạt mang điện nhiều hơn số hạt không mang điện 4 hạt.
Phát biểu nào dưới đây không đúng khi nói về phosphorus?
Khi hình thành liên kết trong phân tử PH3, P và H đưa ra electron góp chung để đạt được cấu hình electron bền vững của khí hiếm
Cho công thức các hợp chất khí với hydrogen của các nguyên tố nhóm VIA như sau: H2O, H2S, H2Se, H2Te. Độ âm điện của O, S, Se, Te lần lượt là 3,44; 2,58; 2,55; 2,10. Dãy nào dưới đây được sắp xếp theo chiều tăng dần nhiệt độ sôi?
Cho các nguyên tố hóa học N (Z = 7), F (Z = 9), Al (Z = 13), Cl (Z = 17) và các giá trị độ âm điện (không theo thứ tự): 1,61; 3,04; 3,16; 3,98. Độ âm điện của F là bao nhiêu?
Cho phổ khối lượng của nguyên tố magnesium như hình sau:
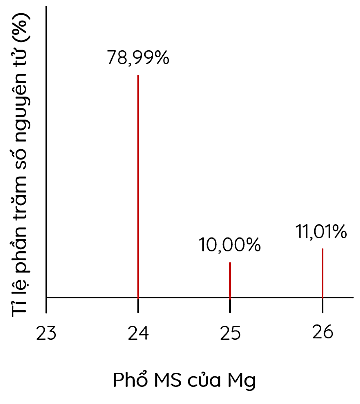
| a) Magnesium có 3 đồng vị bền trong tự nhiên. |
|
| b) Trong tự nhiên tồn tại nguyên tử magnesium có 15 neutron. |
|
| c) Nguyên tử khối trung bình của magnesium là 24,32. |
|
| d) Trong MgCO3, 24Mg chiếm 28,46% về khối lượng. |
|
Oxygen (16O) và fluorine (9F) đều thuộc chu kì 2 trong bảng tuần hoàn các nguyên tố hóa học.
(Nhấp vào ô màu vàng để chọn đúng / sai)| a) Nguyên tử oxygen và fluorine đều có 2 lớp electron. |
|
| b) Oxygen có tính phi kim mạnh hơn fluorine. |
|
| c) Khả năng hút electron của fluorine mạnh hơn oxygen. |
|
| d) Trong hợp chất khí với hydrogen, fluorine chiếm 95% về khối lượng. |
|
Ethanol là hợp chất hữu cơ dễ cháy, không màu, thành phần chính trong các đồ uống có cồn. Ethanol có công thức cấu tạo như sau:
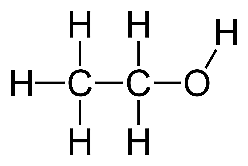
Số hiệu nguyên tử của H, C, O lần lượt là 1, 6 và 8.
(Nhấp vào ô màu vàng để chọn đúng / sai)| a) Trong phân tử ethanol chỉ có liên kết đơn. |
|
| b) Khi hình thành phân tử ethanol, các nguyên tử C, H, O đều có 8 electron lớp ngoài cùng. |
|
| c) Các liên kết trong phân tử ethanol đều được tạo thành từ sự xen phủ trục s – p. |
|
| d) Ethanol tan tốt trong nước do tạo được liên kết hydrogen với nước. |
|
Nguyên tố nitrogen (N, Z = 7) và phosphorus (P, Z = 15) là các nguyên tố điển hình của nhóm VA trong bảng tuần hoàn.
(Nhấp vào ô màu vàng để chọn đúng / sai)| a) Các nguyên tử N và P đều có 3 electron ở lớp ngoài cùng. |
|
| b) Khi tham gia liên kết hóa học, N và P có xu hướng nhận hoặc góp chung 3 electron. |
|
| c) Hợp chất khí với H với P là PH3, công thức oxide ứng với hóa trị cao nhất là P2O5. |
|
| d) NH3 có nhiệt độ sôi cao hơn PH3 do giữa các phân tử NH3 có liên kết hydrogen. |
|
Cho các nguyên tố hóa học sau: Li (Z = 3), O (Z = 8), Na (Z = 11). Viết số hiệu nguyên tử của các nguyên tố trên theo chiều bán kính nguyên tử tăng dần.
Trả lời: .
Sulfur (S) là nguyên tố phổ biến thứ 17 trên vỏ Trái Đất, chiếm khoảng 0,03 – 0,1% khối lượng. Trong cơ thể người, sulfur chiếm khoảng 0,2% khối lượng, có trong thành phần nhiều protein và enzyme. Trong hạt nhân nguyên tử sulfur có 16 proton. Cho các phát biểu sau về sulfur:
(1) Sulfur là nguyên tố khí hiếm.
(2) Sulfur có 2 electron độc thân.
(3) Nguyên tử sulfur có 3 lớp electron.
(4) Sulfur nằm ở chu kì 3, nhóm VIA trong bảng tuần hoàn.
(5) Phân lớp ngoài cùng của sulfur là 3d.
Tổng số thứ tự của các phát biểu đúng là bao nhiêu (ví dụ: các phát biểu đúng là (1), (3), (5) có tổng là 9, điền đáp án là 9)?
Trả lời: .
Nguyên tố X nằm ở chu kì 2, nhóm VIIA trong bảng tuần hoàn. Hợp chất của X có nhiều ứng dụng trong đời sống như làm thuốc đánh răng, chế tạo dụng cụ nhà bếp, sử dụng trong quá trình sản xuất nhôm,... Tổng số hạt mang điện trong nguyên tử X là bao nhiêu?
Trả lời: .
Có bao nhiêu chất ion trong dãy chất sau: Li3N, K2O, SO2, HF, CaCl2.
Trả lời: .
Cho phổ khối lượng của carbon (C) như hình dưới đây:
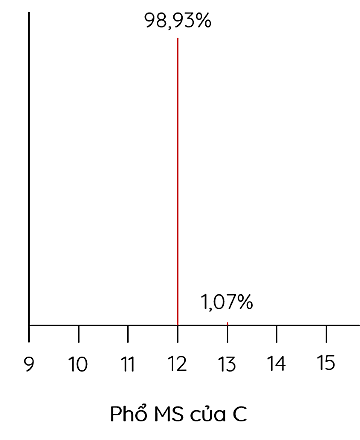
Nguyên tử khối trung bình của carbon là bao nhiêu. Biết z = 1 (làm tròn kết quả đến hàng đơn vị).
Trả lời: .
Tổng số liên kết đơn và liên kết ba trong phân tử C2H2 là bao nhiêu?
Trả lời: .
