Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Dẫn xuất halogen SVIP
I. Khái niệm, danh pháp
1. Khái niệm
Khi thay thế nguyên tử hydrogen trong phân tử hydrocarbon bằng nguyên tử halogen, được dẫn xuất halogen của hydrocarbon.
Công thức tổng quát của dẫn xuất halogen:
RXn |
R: gốc hydrocarbon |
| X: F, Cl, Br, I | |
|---|---|
| n: số nguyên tử halogen |
Ví dụ: CH3Br, CH2Cl2, CHI3, CH2 = CHCl, C6H5Br
2. Đồng phân
Ngoài đồng phân mạch carbon như hydrocarbon, dẫn xuất halogen còn có đồng phân vị trí nhóm chức (vị trí các nguyên tử halogen).
Ví dụ: Ứng với công thức phân tử C4H9Cl có các công thức cấu tạo sau:
.png)
3. Danh pháp
a) Danh pháp thay thế
Tên theo danh pháp thay thế của dẫn xuất halogen:
Vị trí của halogen – halogeno + tên hydrocarbon
Halogeno: đuôi “-ine” trong tên halogen được đổi thành đuôi “-o”.
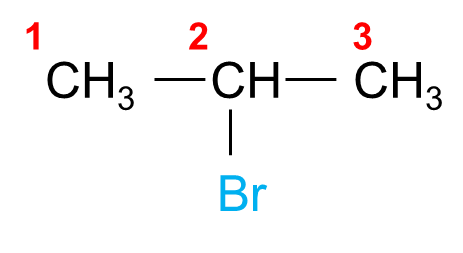
Ví dụ:
 |
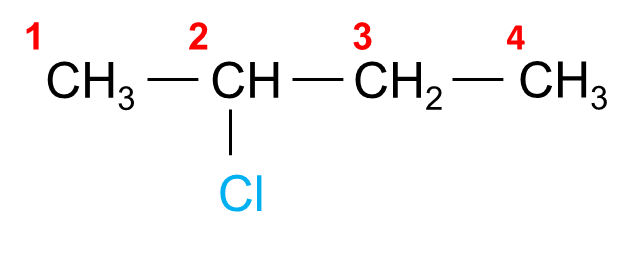 |
| 2 – bromopropane | 2 – chlorobutane |
Chú ý:
- Nếu halogen chỉ có một vị trí duy nhất thì không cần chỉ số vị trí halogen.
- Mạch carbon được ưu tiên đánh số từ phía gần nhóm thế hơn (từ nguyên tử halogen hoặc từ nhánh alkyl).
- Nếu có liên kết bội thì ưu tiên đánh số từ phía gần liên kết bội.
- Nếu có nhiều nguyên tử halogen thì cần thêm độ bội (di, tri, tetra,...) trước “halogeno”.
Ví dụ:
| CH3Br | CH3 – CHCl – CH2 – CH3 | CH2 = CH – CH2F | BrCH2 – CH2Br |
| bromomethane | 2 - chlorobutane | 3 – fluoroprop – 1 - ene | 1, 2 - dibromoethane |
b) Tên thông thường
Một số dẫn xuất halogen thường gặp được gọi theo tên thông thường như chlorofom (CHCl3), bromofom (CHBr3), iodofom (CHI3), CCl4 (carbon tetrachoride).
II. Tính chất vật lí
- Phân tử của dẫn xuất halogen phân cực nên chúng có nhiệt độ nóng chảy và nhiệt độ sôi cao hơn các hydrocarbon có phân tử khối tương đương.
- Ở điều kiện thường, một số chất có phân tử khối nhỏ (CH3Cl, CH3F,...) ở trạng thái khí. Các dẫn xuất có phân tử khối lớn hơn ở trạng thái lỏng hoặc rắn.
- Các dẫn xuất halogen hầu như không tan trong nước, tan tốt trong các dung môi hữu cơ như hydrocarbon, ether,...
III. Tính chất hóa học
Trong phân tử dẫn xuất halogen, liên kết C – X phân cực về phía nguyên tử halogen, nguyên tử carbon mang một phần điện tích dương và nguyên tử halogen mang một phần điện tích âm.

Vì vậy, liên kết C – X đẽ bị phân cắt trong các phản ứng hóa học. Phản ứng đặc trưng của dẫn xuất halogen là phản ứng thế nguyên tử halogen. Ngoài ra, dẫn xuất halogen còn tham gia phản ứng tách HX.
1. Phản ứng thế nguyên tử halogen
Các dẫn xuất halogen có thể tham gia phản ứng với dung dịch kiềm, nguyên tử halogen bị thay thế bởi nhóm OH–, tạo thành alcohol theo phản ứng:
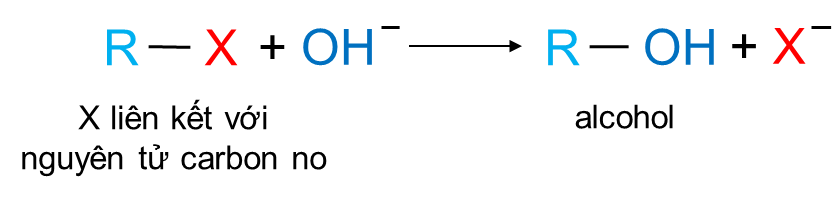
(X = Cl, Br, I)
Ví dụ:
CH3CH3CH2Cl + NaOH \(\overset{t{^\circ}}{\rightarrow}\) CH3CH2CH2OH + NaCl
2. Phản ứng tách hydrogen halide
- Các dẫn xuất monohalogen của alkane có thể bị tách hydrogen halide tạo thành alkene theo sơ đồ sau:
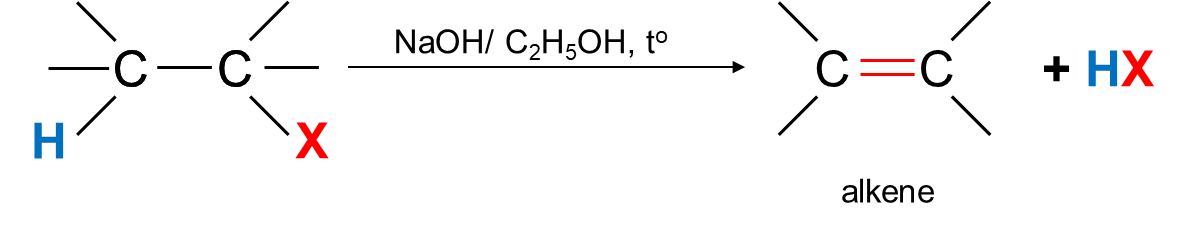
- Phản ứng xảy ra khi đun nóng dẫn xuất halogen với base mạnh như NaOH, RONa trong dung môi alcohol.
Ví dụ:
CH3CH2Br ![]() CH2 = CH2 + HBr
CH2 = CH2 + HBr
- Phản ứng tách xảy ra theo quy tắc Zaitsev (Zai – xép):
Trong phản ứng tách hydrogen halide, nguyên tử halogen bị tách ưu tiên cùng với nguyên tử hydrogen ở carbon bên cạnh có bậc cao hơn.
Ví dụ:

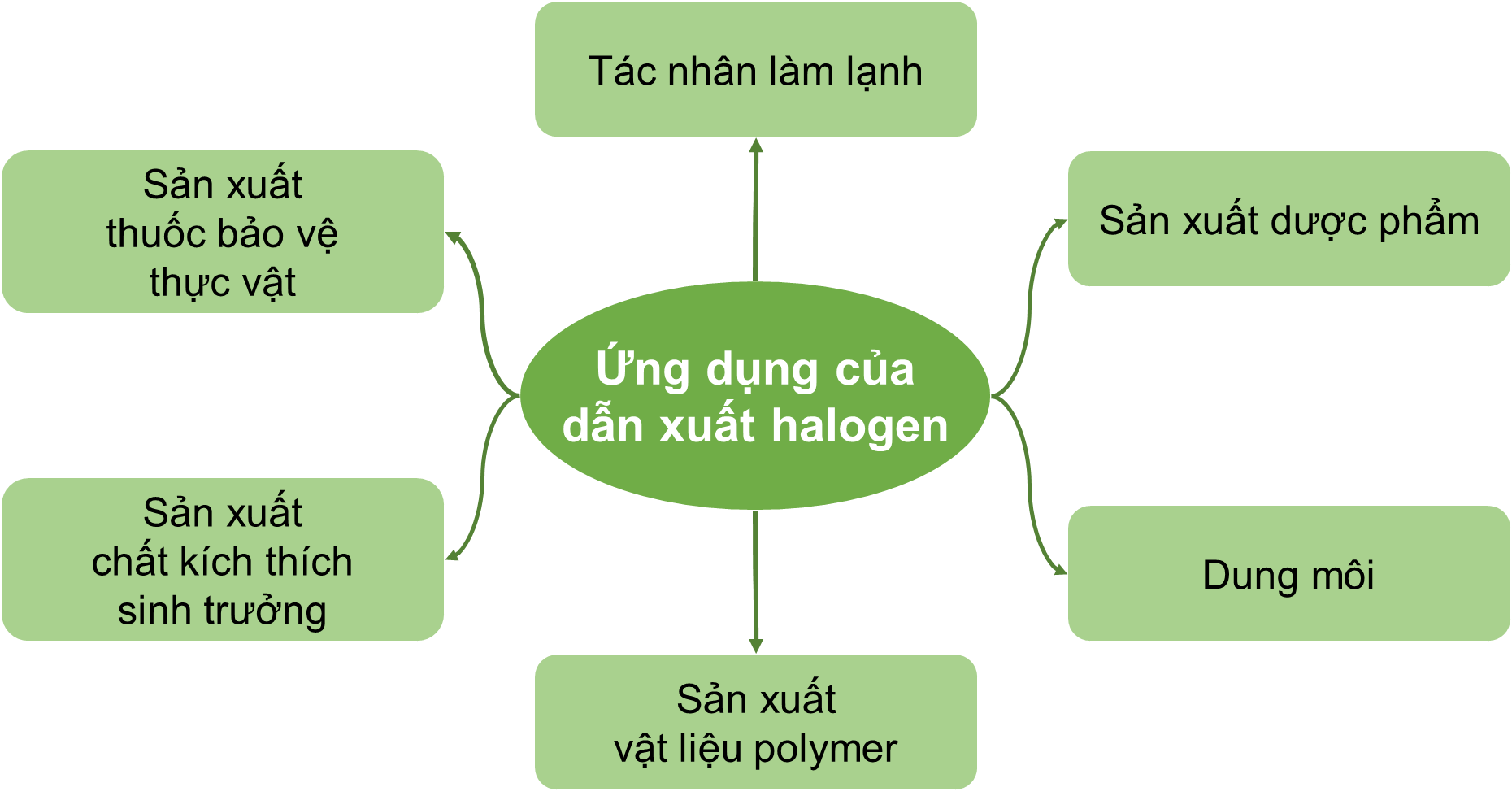
IV. Ứng dụng
1. Công thức tổng quất của dẫn xuất halogen: RXn.
2. Danh pháp thay thế của dẫn xuất halogen:
Vị trí của halogen – halogeno + tên hydrocarbon
3. Dẫn xuất halogen có nhiệt độ nóng chẩy và nhiệt độ sôi cao hơn hydrocarbon có phân tử khối tương đương; khó tan trong nước, tan tốt trong các dung môi hữu cơ.
4. Dẫn xuất halogen có khả năng bị thế nguyên tử halogen:
5. Phản ứng tách HX theo quy tắc Zaitsev: Nguyên tử halogen bị tách ưu tiên cùng với nguyên tử hydrogen ở nguyên tử carbon bên cạnh có bậc cao hơn.
6. Ứng dụng của dẫn xuất halogen: dung môi, vật liệu polymer, chất làm lạnh, dược phẩm, thuốc bảo vệ thực vật, chất bảo vệ thực vật, kích thích sinh trưởng,...

Bạn có thể đánh giá bài học này ở đây