Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Cấu trúc hạt nhân SVIP
I. PHÁT HIỆN RA HẠT NHÂN NGUYÊN TỬ
1. Thí nghiệm tán xạ hạt α
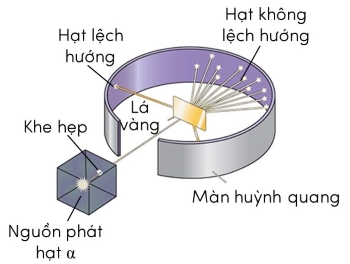
Trong thí nghiệm này, Rutherford sử dụng các lá vàng có độ dày chỉ khoảng 10-6 m. Các hạt α có khối lượng bằng 7300 lần khối lượng hạt electron và mang điện tích +2e.
Kết quả
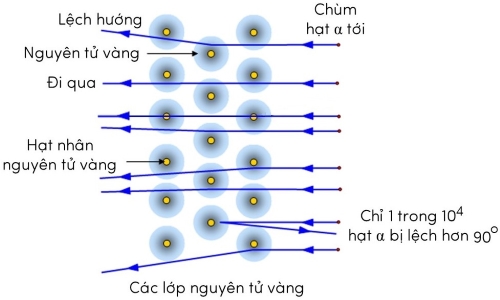
Kết quả thí nghiệm thực tế cho thấy, sau khi được bắn vào lá vàng mỏng, hầu hết các hạt α đi thẳng nhưng có một số hạt bị lệch so với hướng truyền ban đầu (bị tán xạ) với các góc lệch khác nhau. Trong đó, có những hạt α bị lệch ở góc lớn hơn 90o. Thí nghiệm này được gọi là thí nghiệm tán xạ hạt α.
Kết luận
Rutherford kết luận rằng điện tích dương của nguyên tử tập trung trong một thể tích nhỏ ở tâm mà ông gọi là hạt nhân.
Khối lượng của nguyên tử cũng tập trung chủ yếu ở hạt nhân và phần lớn thể tích nguyên tử là không gian trống rỗng.
Đường kính của các hạt nhân nhỏ hơn đường kính của nguyên tử cỡ 104 lần, nghĩa là đường kính hạt nhân cỡ khoảng 10-14 m. Có thể coi hạt nhân nguyên tử như một quả cầu bán kính $R$; $R$ phụ thuộc vào tổng số hạt nucleon $A$ theo công thức gần đúng:
$R=1,2.10^{-15}.A^{\frac{1}{3}}$ (m)
| Tên nguyên tố | Số khối |
Bán kính nguyên tử 10-10 m |
Bán kính hạt nhân 10-15 m |
| Hydrogen | 1 | 1,2 | 0,9 |
| Helium | 4 | 1,4 | 1,7 |
| Oxigen | 16 | 1,5 | 2,7 |
| Silicon | 28 | 2,1 | 3,1 |
| Sắt | 56 | 1,9 | 3,7 |
| Cadimium | 114 | 1,6 | 4,6 |
| Vàng | 197 | 1,7 | 5,4 |
| Uranium | 238 | 1,9 | 5,9 |
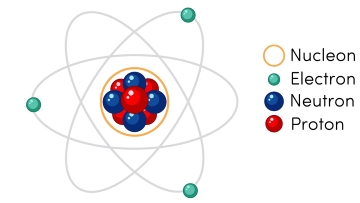
2. Mô hình đơn giản của nguyên tử
Nguyên tử gồm hạt nhân ở giữa mang điện tích dương và các electron chuyển động quanh hạt nhân.
Hạt nhân gồm các proton và neutron. Số proton trong hạt nhân bằng số electron của nguyên tử.
II. CẤU TRÚC HẠT NHÂN
1. Cấu tạo hạt nhân
Hạt nhân được tạo thành bởi hai loại hạt là proton và neutron, hai loại hạt này được gọi chung là nucleon.
| Hạt | Điện tích | Khối lượng |
| Proton (p) | +e | 1,67262.10-27 kg |
| Neutron (n) | 0 | 1,67493.10-27 kg |
Kí hiệu hạt nhân
Người ta dùng kí hiệu hóa học X của nguyên tố để kí hiệu cho hạt nhân, kèm theo hai số Z và A như sau: \(_Z^AX.\)
Ví dụ: hạt nhân carbon có 12 nucleon trong đó có 6 proton được kí hiệu \(_6^{12}C\).
Đồng vị
Các hạt nhân đồng vị là những hạt nhân có cùng số Z, khác số A, nghĩa là cùng số proton và khác số neutron.
Các đồng vị được chia làm hai loại: đồng vị bền và đồng vị phóng xạ (không bền). Hầu hết các mẫu chất trong tự nhiên đều là hỗn hợp của nhiều đồng vị.
Ví dụ: Carbon có ba đồng vị chính là \(_6^{12}C,\) \(_6^{13}C,\) \(_6^{14}C\). trong đó đồng vị \(_6^{12}C\) và \(_6^{13}C\) là đồng vị bền chiếm hơn 99 % carbon tự nhiên.
2. Kích thước và khối lượng hạt nhân
Để thuận lợi tính toán khối lượng của hạt nhân, người ta định nghĩa một đơn vị mới gọi là đơn vị khối lượng nguyên tử, kí hiệu là amu. Đơn vị amu có giá trị bằng $\dfrac{1}{12}$ khối lượng nguyên tử của đồng vị carbon-12:
1 amu \(\approx\) 1,66054.10-27 kg
Số proton trong hạt nhân bằng Z. Tổng số nucleon trong một hạt nhân được kí hiệu là A; A gọi là số khối.
| Proton | Neutron | Helium (4He) | Uranium (235U) |
| 1,00728 | 1,00866 | 4,00151 | 234,99346 |
1. Thí nghiệm tán xạ hạt α đã cung cấp bằng chứng cho sự tồn tại của hạt nhân. Hạt nhân mang điện tích dương, có đường kính cỡ 10-14 m, nằm tại tâm của nguyên tử và tập trung gần như toàn bộ khối lượng nguyên tử.
2. Hạt nhân cấu tạo gồm A nucleon, trong đó có Z proton và $N=A-Z$ neutron.
3. Kí hiệu hạt nhân: \(_Z^AX.\)
4. Đơn vị khối lượng nguyên tử được kí hiệu là amu (viết tắt là u):
1 amu = 1,66054.10-27 kg

Bạn có thể đánh giá bài học này ở đây