Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Áp suất và động năng phân tử chất khí SVIP
I. ÁP SUẤT CHẤT KHÍ
1. Áp suất của khí lên thành bình
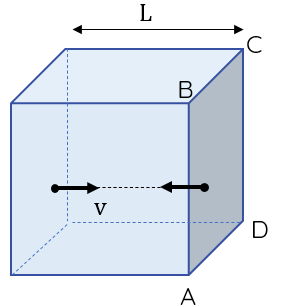
Mô hình phân tử khí chuyển động trong bình hình lập phương
Theo mô hình động học phân tử chất khí, các phân tử khí va chạm với thành bình, truyền động lượng cho thành bình và bị bật trở lại. Mỗi phân tử khí va chạm vào thành bình gây ra áp suất lên thành bình là:
\(p_i=\dfrac{F}{S}\) (1)
Trong đó, $F$ là độ lớn của lực do phân tử khí tác dụng vuông góc lên diện tích $S$ của thành bình. Mỗi phân tử khí tác dụng lên thành bình một áp suất không đáng kể nhưng một số lượng rất lớn các phân tử khí va chạm vào thành bình sẽ gây ra áp suất chất khí đủ lớn.
2. Công thức tính áp suất khí
Để đơn giản, xét một phân tử khí chuyển động trong một bình hình lập phương, mỗi cạnh có chiều dài $L$ rất nhỏ. Phân tử này có khối lượng $m$ và đang di chuyển với tốc độ $v$ theo phương song song với một cạnh của bình.
Xét một va chạm đàn hồi của phân tử vào thành bình. Phản lực của thành bình làm phân tử khí bật ra và chuyển động theo hướng ngược lại. Động lượng của phân tử thay đổi từ $mv$ thành $-mv$. Trong thời gian giữa hai va chạm liên tiếp của phân tử với thành bình, động lượng của phân tử thay đổi một lượng có độ lớn là $2mv$.
Thời gian giữa một lần va chạm của phân tử với thành bình ABCD và lần va chạm tiếp theo của nó với cùng thành bình đó là \(\Delta t=\dfrac{2L}{v}\). Do giữa hai va chạm liên tiếp, phân tử khí lí tưởng chuyển động thẳng đều nên \(\Delta t\) là thời gian mà động lượng của phân tử khí biến thiên một lượng là $2mv$.
Vậy độ lớn trung bình của lực gây ra thay đổi động lượng của phân tử khí đang xét là:
\(F=\dfrac{2mv}{\dfrac{2L}{v}}=\dfrac{mv^2}{L}\) (2)
Lực do phân tử khí tác dụng lên thành bình ABCD có cùng độ lớn với $F$.
Vậy áp suất do một phân tử khí gây ra là:
\(p_i=\dfrac{F}{S}=\dfrac{\dfrac{mv^2}{L}}{L^2}=\dfrac{mv^2}{L^3}\)
Vì trong bình có một số lượng lớn các phân tử khí, mỗi phân tử có một giá trị \(v^2\) khác nhau, nên khi tính giá trị trung bình của \(p_i\), ta phải lấy giá trị trung bình của \(v^2\) (kí hiệu \(\overline{v^2}\)).
Nếu trong bình có $N$ phân tử thì áp suất do chúng gây ra được tính như sau:
\(p=\dfrac{Nm\overline{v^2}}{L^3}\)
Thực tế, các phân tử trong bình chuyển động hỗn loạn không có phương nào ưu tiên, tức là chúng chuyển động và va chạm với ba cặp mặt đối diện của hình lập phương như nhau. Do đó, ta phải chia kết quả đã tính cho 3 để được áp suất do tất cả các phân tử gây ra lên mỗi mặt của hình lập phương. Ta thu được:
\(p=\dfrac{1}{3}\dfrac{Nm\overline{v^2}}{V}\) (3)
Gọi \(\mu\) là số phân tử khí trong một đơn vị thể tích. Áp suất do các phân tử khí tác dụng lên thành bình được tính bằng công thức:
\(p=\dfrac{1}{3}\mu m\overline{v^2}\) (4)
Vì $Nm$ là khối lượng của tất cả các phân tử khí, tức là khối lượng của lượng khí trong bình nên ta có:
\(p=\dfrac{1}{3}\rho\overline{v^2}\) (5)
Với \(\rho\) là khối lượng riêng của chất khí.
II. ĐỘNG NĂNG PHÂN TỬ KHÍ LÍ TƯỞNG
Từ phương trình (3) và phương trình trạng thái của khí lí tưởng ta rút ra được:
\(m\overline{v^2}=\dfrac{3RT}{N_A}\) (6)
Với \(N_A=\dfrac{N}{n}\) là số Avogadro, tức là số phân tử trong một mol khí. Động năng trung bình của phân tử khí là \(W_đ=\dfrac{mv^2}{2}\), ta có:
\(\dfrac{m\overline{v^2}}{2}=\dfrac{3RT}{2N_A}\)
Do $R$ và \(N_A\) đều là hằng số nên \(k=\dfrac{R}{N_A}\) cũng là hằng số và được gọi là hằng số Boltzmann.
Ta thu được biểu thức tính động năng phân tử chất khí:
\(W_đ=\dfrac{m\overline{v^2}}{2}=\dfrac{3kT}{2}\) (7)
Khi thành lập công thức (7), ta chưa xét chuyển động quay của phân tử khí. Người ta gọi động năng chưa tính đến động năng quay hay dao động của phân tử là động năng tịnh tiến của phân tử khí lí tưởng.
Công thức (7) cho thấy: Động năng tịnh tiến trung bình của phân tử khí lí tưởng tỉ lệ thuận với nhiệt độ $T$.
1. Áp suất khí lí tưởng: \(p=\dfrac{1}{3}\dfrac{Nm\overline{v^2}}{V}=\dfrac{1}{3}\rho\overline{v^2}\)
2. Hằng số Boltzmann: \(k=\dfrac{R}{N_A}\)
3. Động năng tịnh tiến trung bình của phân tử khí lí tưởng tỉ lệ thuận với nhiệt độ $T$:
\(\dfrac{1}{2}m\overline{v^2}=\dfrac{3}{2}kT\)

Bạn có thể đánh giá bài học này ở đây