Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Ammonia và một số hợp chất ammonium SVIP
I. Cấu tạo phân tử ammonia
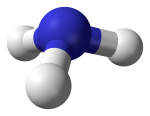
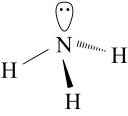
Phân tử ammonia được tạo bởi một nguyên tử nitrogen liên kết với ba nguyên tử hydrogen và có dạng hình học là chóp tam giác.
|
|
II. Tính chất của ammonia
1. Tính chất vật lí
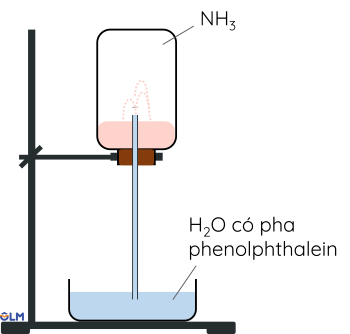
Ở điều kiện thường, ammonia tồn tại dưới dạng thể khí, không màu, mùi khai và xốc, nhẹ hơn không khí.
Ammonia tan nhiều trong nước, ở điều kiện thường do ammonia tạo được liên kết hydrogen với nước.
2. Tính chất hóa học
Trong dung dịch, một phần số phân tử ammonium nhận proton của nước, tạo thành ion ammonium NH4+ và ion OH-.
\(NH_3+H_2O⇌NH_4^++OH^-\)
Ammonia kết hợp dễ dàng với acid tạo thành muối ammonium.
\(NH_3+HCl\rightarrow NH_4Cl\)
Khi đốt cháy trong khí O2, NH3 cháy với ngọn lửa màu vàng.
\(4NH_3+3O_2\overset{t^o}{\rightarrow}2N_2+6H_2O\)
Khi oxi hóa ammonia bằng oxygen trong không khí nhiệt độ cao (800 – 900 oC) với xúc tác Pt tạo thành NO và H2O.
\(4NH_3+5O_2\overset{Pt,t^o}{\rightarrow}4NO+6H_2O\)
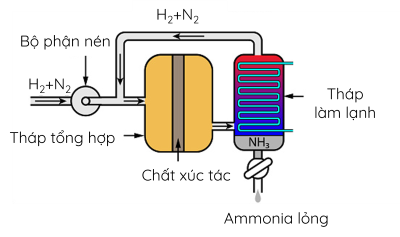
III. Tổng hợp ammonia
Trong công nghiệp, quá trình sản xuất ammonia thường được thực hiện ở nhiệt độ 400 – 450 oC, áp suất 150 – 200 bar, xúc tác Fe.
| \(N_2\left(g\right)+3H_2\left(g\right)⇌2NH_3\left(g\right)\) | \(\Delta_rH^o_{298}=-92\) kJ |
IV. Muối ammonium
1. Tính chất vật lí của muối ammonium
Muối ammonium đều được tạo bởi cation ammonium (NH4+) và anion gốc acid.
Một số muối ammonium phổ biến: NH4Cl, NH4ClO4, NH4NO3, (NH4)2SO4, NH4H2PO4, (NH4)2HPO4, NH4HCO3, (NH4)2Cr2O7.
2. Tính chất hóa học của muối ammonium
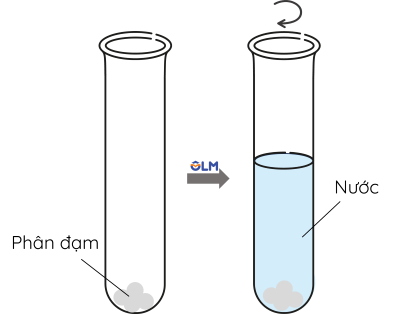
Thí nghiệm: Nhận biết ion ammonium trong phân đạm
Bước 1: Cho khoảng 2 gam phân đạm ammonium vào ống nghiệm. Sau đó cho khoảng 2 mL nước cất và lắc đến khi tan hết.
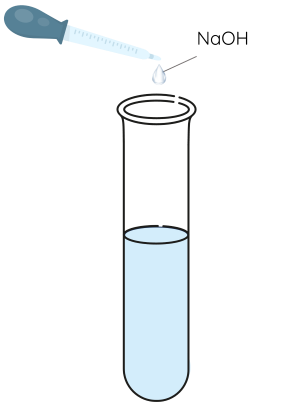
Bước 2: Nhỏ 2 mL dung dịch NaOH đặc vào mỗi ống nghiệm, đun nóng nhẹ trên đèn cồn.
Bước 3: Đưa hai mẫu giấy pH đã tẩm ướt vào mỗi ống nghiệm.

Dung dịch muối ammonium đặc tác dụng với dung dịch kiềm sinh ra khí ammonia có mùi khai.
\(NH_4^++OH^-\overset{t^o}{\rightarrow}NH_3\uparrow+H_2O\)
Các muối ammonium đều kém bền nhiệt và dễ bị phân hủy khi nung nóng.
Ví dụ:
\(NH_4Cl\overset{t^o}{\rightarrow}NH_3+HCl\)
\(NH_4HCO_3\overset{t^o}{\rightarrow}NH_3+CO_2+H_2O\)
\(NH_4NO_3\overset{t^o}{\rightarrow}N_2O+H_2O\)
V. Ứng dụng
1. Ứng dụng của ammonia
Ammonia được dùng để sản xuất nitric acid, các loại phân đạm, chất làm lạnh, dung môi và nhiều ứng dụng quan trọng trong đời sống và sản xuất.
2. Ứng dụng của muối ammonium
Muối ammonium nitrate (NH4NO3) được sử dụng làm phân bón giúp thức đẩy quá trình tăng trưởng của cây. Một số muối ammoni khác cũng được dùng làm phân bón như phân đạm, phân bón phức hợp,...

1. Phân tử NH3 có cấu trúc chóp tam giác, với nguyên tử nitrogen ở đỉnh, đáy là một tam giác mà đỉnh là 3 nguyên tử hydrogen.
2. Ammonia là chất khí không màu, mùi khai và xốc, nhẹ hơn không khí. Ammonia tan rất nhiều trong nước tạo thành dung dịch ammonia. Dung dịch ammonia đậm đặc thường có nồng độ 25%.
3. Ammonia chủ yếu thể hiện tính khử và tính base trong các phản ứng hóa học.
4. Quá trình Haber được thực hiện như sau:
- Hỗn hợp nitrogen và hydrogen (tỉ lệ mol 1: 3) được nén áp suất cao và đưa vào tháp tổng hợp ammonia trong điều kiện nhiệt độ, áp suất và chất xúc tác thích hợp.
- Hỗn hợp khí đi ra từ tháp tổng hợp gồm N2, H2 và NH3 được dẫn đến tháp làm lạnh. Ở đây, NH3 hóa lỏng và được tách riêng, còn hỗn hợp khí N2 và H2 chưa phản ứng được đưa trở lại tháp tổng hợp.
5. Muối ammonium là những chất tinh chế ion. Hầu hết các muối ammonium dễ tan trong nước.
6. Muối ammonium tác dụng với dung dịch kiềm khi đun nóng cho khí ammonia có mùi xốc đặc trưng. Phản ứng này dùng để nhận biết ion ammonium trong dung dịch.
Muối ammonium dễ bị phân hủy khi đun nóng.
7. Ammonia được sử dụng để sản xuất nitric acid, các loại phân đạm. Ammonia còn được sử dụng làm chất làm lạnh, làm dung môi và nhiều ứng dụng quan trọng khác trong đời sống và sản xuất.
8. Muối ammonium được sử dụng rộng rãi trong đời sống và sản xuất, đặc biệt được dùng làm phân bón trong nông nghiệp.

Bạn có thể đánh giá bài học này ở đây