Bài học cùng chủ đề
Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Amine SVIP
1. Khái niệm và cấu trúc
Khái niệm và cách phân loại amine
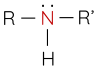
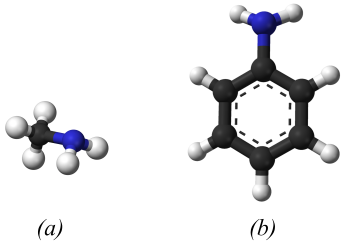
Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon.
Amine là hợp chất hữu cơ, có nhiều chức năng trong cơ thể sống như điều hòa sinh học, dẫn truyền thần kinh,... Amine thường được phân loại theo bậc:

|
|

|
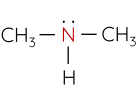
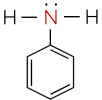
Amine có nguyên tử nitrogen liên kết trực tiếp với nguyên tử carbon của vòng benzene gọi là arylamine, nguyên tử nitrogen liên kết với gốc alkyl gọi là alkylamine.
|
|
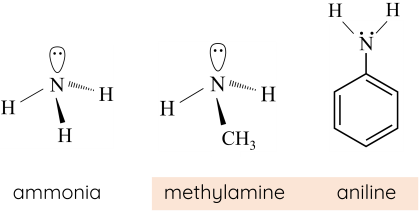
Đặc điểm cấu tạo, hình dạng phân tử methylamine và aniline
2. Đồng phân và danh pháp
Khi thay đổi mạch carbon, vị trí nhóm chức hoặc số nhóm thế liên kết với nguyên tử nitrogen thu được các đồng phân amine.
Amine thường được gọi tên theo tên gốc – chức và tên thay thế.
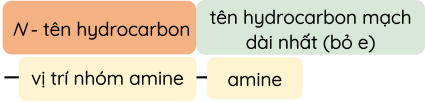
- Tên của amine theo danh pháp gốc - chức:

- Tên của amine theo danh pháp thay thế:
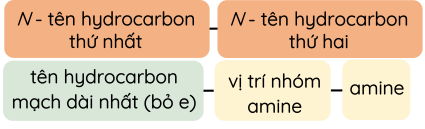
- Amine bậc 1

- Amine bậc 2
- Amine bậc 3
Ví dụ 1: Amine ứng với công thức phân tử C4H11N có các công thức cấu tạo, tên gốc – chức (màu đỏ) và tên thay thế (màu xanh dương) như sau:

@203193819815@@203193870847@
3. Tính chất vật lí
Nhiệt độ nóng chảy, nhiệt độ sôi, độ tan trong nước của một số amine được thể hiện trong bảng sau:
|
Amine |
Nhiệt độ nóng chảy (oC) | Nhiệt độ sôi (oC) | Độ tan trong nước ở 25 oC (g/100g H2O) |
|
CH3NH2 |
-95 |
-6 |
Tan nhiều |
|
CH3CH2NH2 |
-81 |
17 |
Tan nhiều |
|
CH3NHCH3 |
-93 |
7 |
Tan nhiều |
|
(CH3)3N |
-117 |
3 |
Tan nhiều |
|
C6H5NH2 |
-6 |
184 |
3,7 |
Giữa các phân tử amine bậc một hoặc amine bậc hai hình thành liên kết hydrogen liên phân tử, ảnh hưởng đến nhiệt độ nóng chảy, nhiệt độ sôi của amine. Giữa phân tử amine với phân tử nước hình thành liên kết hydrogen, ảnh hưởng đến độ tan trong nước của amine.
4. Tính chất hóa học
Tính base của nhóm NH2
Trong dung dịch, amine phản ứng với H2O tạo ra ion ammonium và ion hydroxide.
\(RNH_2+H_2O⇌RNH_3^++OH^-\)
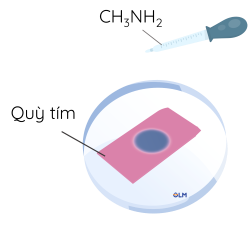
Thí nghiệm 1: Tính base của methylamine
- Phản ứng với chất chỉ thị
Nhỏ một giọt dung dịch methylamine lên mẩu giấy quỳ tím đặt trên đĩa thủy tinh
- Phản ứng với dung dịch acid
Bước 1: Thêm vài giọt phenolphthalein vào ống nghiệm chứa 2 mL dung dịch methylamine.
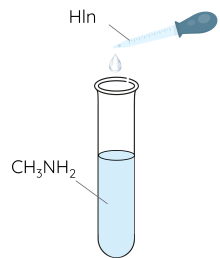
Bước 2: Nhỏ từ từ 2 mL dung dịch HCl vào ống nghiệm, lắc đều.

- Phản ứng với dung dịch muối
Thêm khoảng 3 mL dung dịch methylamine vào ống nghiệm chứa khoảng 1 mL dung dịch FeCl3 và lắc đều.

Phương trình hóa học của các phản ứng:
\(CH_3NH_2+HCl\rightarrow CH_3NH_3Cl\)
\(FeCl_3+3CH_3NH_2+3H_2O\rightarrow Fe\left(OH\right)_3\downarrow+3CH_3NH_3Cl\)
Tính base của aniline yếu hơn methylamine và dung dịch aniline không làm đổi màu quỳ tím.
Phản ứng với nitrous acid (H-O-N=O)
Amine phản ứng với nitrous acid, sản phẩm phụ thuộc vào bậc của amine, bản chất của gốc hydrocarbon, điều kiện tiến hành,...
Ví dụ 2: Ethylamine phản ứng với HNO2, sinh ra nitrogen và ethanol.
\(C_2H_5NH_2+HNO_2\rightarrow C_2H_5OH+N_2\uparrow+H_2O\)
Ví dụ 3: Aniline phản ứng với HNO2 ở nhiệt độ thấp (0 - 5 oC) sinh ra muối diazonium.
\(C_6H_5NH_2+HNO_2+HCl\overset{0-5^oC}{\rightarrow}\left[C_6H_5N_2\right]^+Cl^-+2H_2O\)
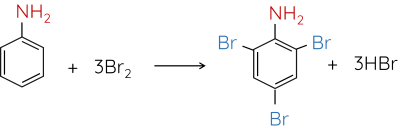
Phản ứng ở nhân thơm của aniline
Thí nghiệm: Phản ứng của aniline với nước bromine
Thêm khoảng 2 mL dung dịch aniline vào ống nghiệm chứa khoảng 1 mL nước bromine.
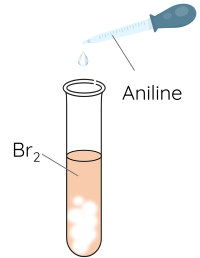
Do ảnh hưởng của nhóm –NH2, aniline dễ tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene, ưu tiên thế vào các vị trí ortho và para so với nhóm NH2.
Phản ứng tạo phức của methylamine hoặc ethylamine
Thí nghiệm 3: Methylamine phản ứng tạo phức với Cu(OH)2
Bước 1: Cho khoảng 0,5 mL dung dịch CuSO4 vào ống nghiệm.
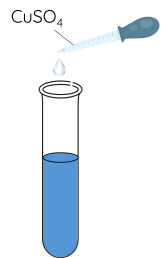
Bước 2: Thêm từ từ khoảng 4 mL dung dịch methylamine vào ống nghiệm, lắc đều.
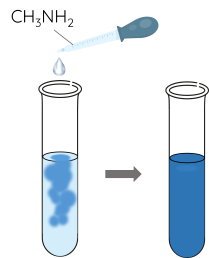
Phương trình hóa học của phản ứng:
\(CuSO_4+2CH_3NH_2+2H_2O\rightarrow Cu\left(OH\right)_2\downarrow+\left(CH_2NH_3\right)_2SO_4\)
Dung dịch methylamine hòa tan được kết tủa Cu(OH)2, tạo thành dung dịch có màu xanh lam là phức chất của methylamine với Cu2+.
\(Cu\left(OH\right)_2+4CH_3NH_2\rightarrow\left[Cu\left(CH_3NH_2\right)_4\right]\left(OH\right)_2\)
5. Ứng dụng và điều chế
Ứng dụng của amine
Amine được ứng dụng trong nhiều lĩnh vực, như tổng hợp polyamide, dược phẩm, hoá chất sử dụng trong nông nghiệp và các vật liệu khác. Ví dụ như examethylenediamine được sử dụng để tổng hợp nylon-6,6. Aniline thường được sử dụng để sản xuất phẩm nhuộm, dược phẩm.

Phương pháp điều chế amine
- Khử hợp chất nitro
Hợp chất có nhóm nitro có thể bị khử thành nhóm amine bởi một số kim loại như Fe, Zn,... trong môi trường acid.
Ví dụ 4:
\(C_6H_5NO_2+6\left[H\right]\xrightarrow[t^o]{Fe+HCl}C_6H_5NH_2+2H_2O\)
- Alkylamine hóa ammonia
Dẫn xuất halogen phản ứng với ammonia có thể tạo ra các sản phẩm là amine bậc một, bậc hai, bậc ba.
Ví dụ 5:
\(NH_3\xrightarrow[-HBr]{+CH_3Br}NH_2\left(CH_3\right)\xrightarrow[-HBr]{+CH_3Br}NH\left(CH_3\right)_2\xrightarrow[-HBr]{+CH_3Br}N\left(CH_3\right)_3\)
1. Amine là dẫn xuất của ammonia, trong đó nguyên tử hydrogen trong phân tử ammonia được thay thế bằng gốc hydrocarbon. Có thể phân loại amine theo bậc amine (amine bậc một, bậc hai và bậc ba) hoặc theo đặc điểm cấu tạo gốc hydrocarbon (alkylamine và arylamine).
2. Amine có tính base yếu; một số amine như methylamine, ethylamine tạo được hợp chất phức với Cu2+; các alkylamine bậc một phản ứng với HNO2 tạo thành alcohol và giải phóng N2; Aniline phản ứng với HNO2 ở nhiệt độ thấp tạo muối diazonium; aniline dễ tham gia phản ứng thế nguyên tử H của vòng benzene hơn so với benzene.
3. Các amine được điều chế bằng cách alkyl hóa ammonia hoặc khử hợp chất nitro.
4. Các amine là nguyên liệu cho công nghiệp tổng hợp phẩm nhuộm, dược phẩm, polymer và tơ sợi.

Bạn có thể đánh giá bài học này ở đây