\(1.\)Nhiệt phân hoàn toàn 12,25g KClO3 (xúc tác MnO2), thu được V lít khí oxi (ở đktc). Giá trị của V là
A. 2,24 | B. 3,36 | C. 4,48 | D. 6,72
|
\(2.\)Hố vôi tôi (Ca(OH)2) để lâu ngày ngoài không khí thấy có màng trắng mỏng ở lớp nước trên mặt hố. Nguyên nhân gây ra hiện tượng là
A. Trong không khí có chứa hơi nước | C. Trong không khí có chứa khí nitơ |
B. Trong không khí có chứa khí H2 | D. Trong không khí có chứa khí CO2 |
\(3.\)Hiện tượng quan sát được khi đốt cháy photpho đỏ trong khí oxi là
A. | Photpho cháy mạnh với ngọn lửa màu xanh nhạt, tạo khói trắng dày đặc dưới dạng bột. | ||||||||||||
B. | Photpho cháy mạnh với ngọn lửa màu xanh nhạt, tạo khói đen dày đặc dưới dạng bột. | ||||||||||||
C. | Photpho cháy mạnh với ngọn lửa sáng chói, tạo khói đen dày đặc dưới dạng bột. | ||||||||||||
D. | Photpho cháy mạnh với ngọn lửa sáng chói, tạo khói trắng dày đặc dưới dạng bột.
4. Cho các phát biểu sau: (a) Khí oxi không màu, không mùi, tan nhiều trong nước. (b) Khí oxi cần cho sự hô hấp và sự cháy. (c) Không khí có thành phần chính là khí nitơ và khí oxi. (d) Thu khí oxi bằng cách đẩy không khí, để úp ống nghiệm. Số phát biểu đúng là
5. Dãy chất nào sau đây đều tác dụng với khí oxi (ở điều kiện thích hợp)?
|

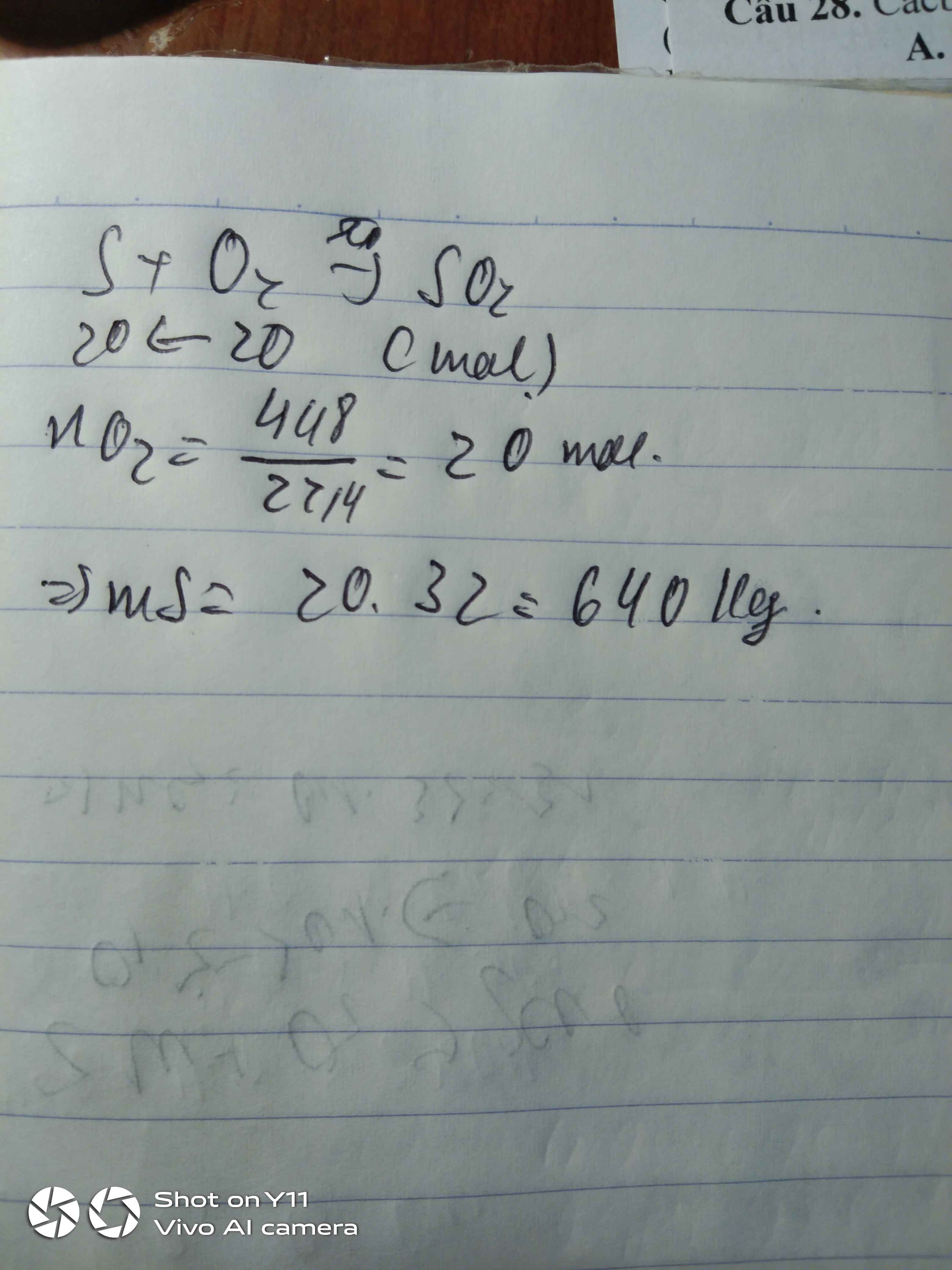

Câu 1:
nKClO3=12,25122,5=0,1mol
2KClO3→(to,MnO2)2KCl+3O2
0,1 0,15 ( mol )
VO2=0,15.22,4=3,36l
=> Chọn B