: Trộn 200 mL dung dịch HCl 0,1M với 100 mL HNO3 0,15M thì thu được dung dịch X chứa bao nhiêu mol ion H+?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


a) \(Al_2O_3+H_2SO_4\rightarrow X+H_2O\)
X là chất Al2(SO4)3
b) \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
c) áp dụng công thức định luật bảo toàn khối lượng
\(m_{H_2SO_4}=m_{Al_2\left(SO_4\right)_3}+m_{H_2O}-m_{Al_2O_3}=34,2+5,4-10,1=29,5\left(g\right)\)
vậy a = 29,5 g

\(n_{H_2SO_4}=0,5.0,6=03\left(mol\right)\)
Gọi \(\left\{{}\begin{matrix}n_{Zn}=x\\n_{CuO}=y\end{matrix}\right.\)
\(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
x x x
\(CuO+H_2SO_4\rightarrow CuSO_4+H_2O\)
y y
Có hệ phương trình:
\(\left\{{}\begin{matrix}65x+80y=21\\x+y=0,3\end{matrix}\right.\)
=>
x=0,2
y=0,1
a. \(m_{Zn}=0,2.65=13\left(g\right),m_{CuO}=80.0,1=8\left(g\right)\)
\(\%m_{Zn}=\dfrac{13.100\%}{21}=61,9\%\\ \%m_{CuO}=\dfrac{8.100\%}{21}=38,1\%\)
b. Có 1 phân tử khí \(H_2\) bay ra
a. Gọi số mol của Zn và CuO lần lượt là x và y.
Zn + H2SO4 → ZnSO4 + H2
x x
CuO + H2SO4 → CuSO4 + H2O
y y
\(n_{H_2SO_4}\) = 0,6 . 0,5 = 0,3 mol
Ta có: \(\left\{{}\begin{matrix}65x+80y=21\\x+y=0,3\end{matrix}\right.\)↔\(\left\{{}\begin{matrix}x=0,2\\y=0,1\end{matrix}\right.\)
⇒ mZn = 13 gam ⇒ %Zn = 62%
⇒mCuO = 8 gam ⇒ % CuO = 38%
b. Khí thoát ra là khí H2.
⇒ \(n_{H_2}\)= 0,2 mol

MgO + 2HCl → MgCl2 + H2O
Fe + 2HCl → FeCl2 + H2
a. \(n_{H_2}\)= 0,1 mol
⇒ nFe = 0,1 mol ⇒ mFe = 5,6 gam
⇒ mMgO = 40 gam ⇒ nMgO = 0,1 mol
b. Thể tích HCl đã dùng là
V = \(\dfrac{n}{C_M}\) = \(\dfrac{0,1.2+0,1.2}{1}\) = 0,4 lít = 400 mL

\(CuO+2HNO_3\rightarrow Cu\left(NO_3\right)_2+H_2O\)
0,2 0,4 0,2
Giả sử \(HNO_3\) không dư, phản ứng trên vừa đủ.
Dung dịch X chỉ chứa duy nhất \(Cu\left(NO_3\right)_2\)
\(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
0,25<------0,5
\(n_{NaOH}=0,5.1=0,5\left(mol\right)\)
Từ phương trình hóa học thấy 0,25>0,2 => Giả sử sai, \(HNO_3\) dư sau phản ứng.
Đặt số mol \(HNO_3\) dư là x
\(HNO_3+NaOH\rightarrow NaNO_3+H_2O\)
x------->x
\(Cu\left(NO_3\right)_2+2NaOH\rightarrow Cu\left(OH\right)_2+2NaNO_3\)
0,2---------->0,4
Có: \(x+0,4=n_{NaOH}=0,5\Rightarrow x=0,1\)
=> Tổng mol \(HNO_3=0,4+x=0,4+0,1=0,5\left(mol\right)\)
\(\Rightarrow CM_{HNO_3}=\dfrac{0,5}{0,2}=2,5\left(M\right)\)

- Trích mẫu thử.
- Nhỏ vài giọt từng mẫu thử vào giấy quỳ tím.
+ Quỳ hóa đỏ: HCl, H2SO4 (1)
+ Quỳ không đổi màu: NaCl
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(BaCl_2+H_2SO_4\rightarrow BaSO_4+2HCl\)
+ Không hiện tượng: HCl
- Dán nhãn.

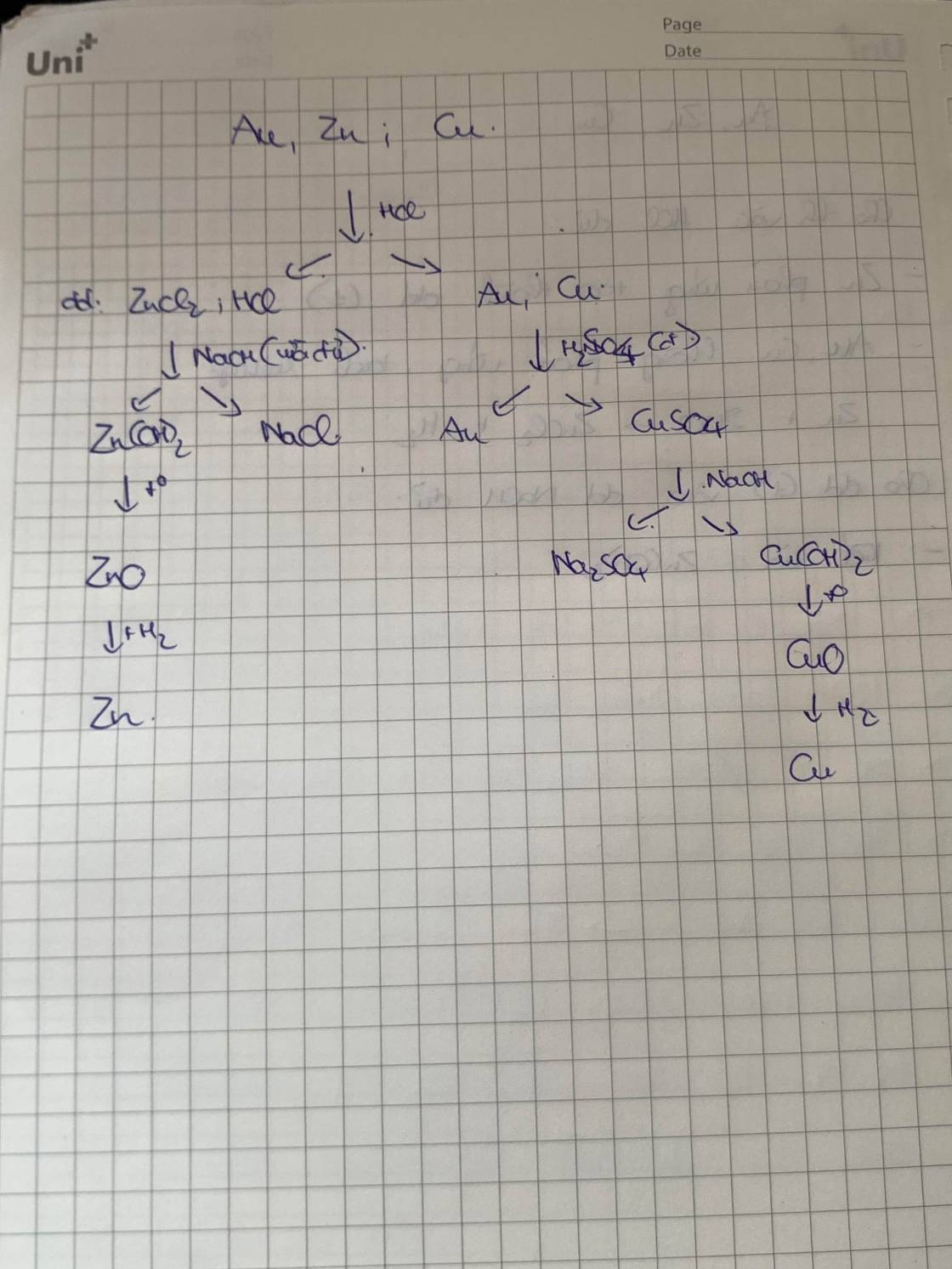
Bước 1: Nung chảy hỗn hợp của cả 3 kim loại.
Bước 2: Khi hỗn hợp đã nóng chảy, sẽ thấy các lớp kim loại tách ra dựa trên mật độ của chúng. Vàng, có mật độ cao hơn, sẽ nằm ở đáy. Đồng sẽ nằm ở giữa và kẽm sẽ ở trên cùng.
Bước 3: Dùng một cái muôi hoặc ống hút, là đã có thể lấy từng lớp kim loại ra khỏi hỗn hợp.
Tick cho e với

| Thành phần | Công thức hóa học | Phân tử khối |
| Na và Cl | NaCl | 58,5 |
| Mg và CO3 | MgCO3 | 84 |
| K và OH | KOH | 56 |
0,117 mol ion H+