Cho 22 gam hỗn hợp Fe và Ag vào lượng dư dung dịch H2SO4 loãng thu được 4,48 lít
khí H2 (đktc). Phần trăm số mol Ag trong hỗn hợp ban đầu là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn Fe: nFe(bđ) = 0,012 + 0,12 + 0,01.3 + 0,01.2 = 0,182 (mol)
=> m = 0,182.56 = 10,192 (g)

Gọi \(n_{O_3\left(pư\right)}=a\left(mol\right)\left(đk:a>0\right)\)
PTHH: \(2Ag+O_3\rightarrow Ag_2O+O_2\uparrow\)
a---------------->a
\(m_{tăng}=m_{O_3\left(pư\right)}-m_{O_2\left(sinh.ra\right)}=48a-32a=1,28\\ \Leftrightarrow a=0,08\left(mol\right)\left(TM\right)\\ n_X=\dfrac{44,8}{22,4}=2\left(mol\right)\\ \rightarrow\%V_{O_3}=\dfrac{0,08}{2}.100\%=8\%\)

AXIT: HCl ( axit clohidric) , HNO3 ( axit nitric)
BAZO: NaOH ( Natri hidroxit)
MUỐI: FeSO4 ( Sắt Sunfat) , KCl (Kali clorua), Al2(SO4)3 ( Nhôm Sunfat)
ÕXIT ÃXIT: SO3 ( Lưu huỳnh trioxit) , P2O5 ( ddiPhotpho pentaoxit)
ÕXIT BAZO: FeO (Sắt (2) Oxit), MgO ( Magie Oxit)

2Al+3H2SO4->Al2(SO4)3+3H2
0,188------------------0,0944
n Al=0,188 mol
=>m Al2(SO4)3=0,0944.342=32,2848g
Đáp án+Giải thích các bước giải:
`n_{Al} = m/M = {5,4}/{27}` `= 0,2` `[mol]`
`PTHH :`
`2Al + 3H_2SO_4 -> Al_2[SO_4]_3 + 3H_2uparrow`
Dựa theo phương trình, ta có :
`n_{H_2} = 3/2n_{Al} = 3/2xx0,2 = 0,3` `[mol]`
`->` `V_{H_2 [đktc]} = nxx22,4 = 0,3xx22,4 = 6,72` `[l]`

2Fe+6H2SO4−−>Fe2(SO4)3+6H2O+3SO2
x--------------------------------------------------------------1,5x(mol)
Cu+2H2SO4−−>CuSO4+H2O+SO2
y---------------------------------------------------y(mol)
nSO2=5,622,4=0,25(mol)
Theo bài ta có hpt
{56x+64y=121,5
x+y=0,25
⇒{x=0,1y=0,1
mFe=0,1.56=5,6(g)
mCu=0,1.64=6,4(g)
=>%Fe=46,67%
=>%Cu=53,33%
=>VH2SO4=\(\dfrac{0,5}{1}\)=0,5l=500ml

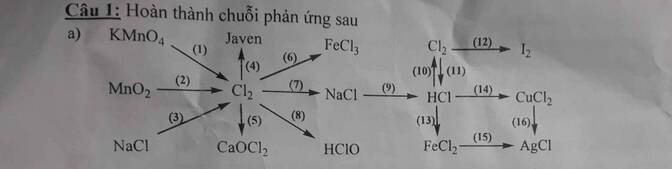
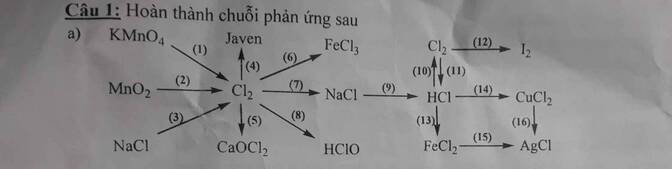
\(\left(1\right)2KMnO_4+16HCl\rightarrow2KCl+2MnCl_2+8H_2O+5Cl_2\uparrow\\ \left(2\right)MnO_2+4HCl\rightarrow MnCl_2+2H_2O+Cl_2\uparrow\\ \left(3\right)2NaCl\underrightarrow{dpnc}2Na+Cl_2\uparrow\\\left(4\right)Cl_2+2NaOH\rightarrow NaCl+NaClO+H_2O\\ \left(5\right)CaOCl_2+2HCl\rightarrow CaCl_2+H_2O+Cl_2\uparrow\)
\(\left(6\right)2Fe+3Cl_2\underrightarrow{t^o}2FeCl_3\\ \left(7\right)Cl_2+2Na\underrightarrow{t^o}2NaCl\\ \left(8\right)Cl_2+H_2O⇌HCl+HClO\)
\(\left(9\right)NaCl+H_2SO_4\underrightarrow{t^o}NaHSO_4+HCl\\ \left(10\right)4HCl+MnO_2\rightarrow MnCl_2+2H_2O+Cl_2\uparrow\\ \left(11\right)Cl_2+H_2\underrightarrow{as}2HCl\\ \left(13\right)2HCl+Fe\rightarrow FeCl_2+H_2\uparrow\\ \left(14\right)2HCl+CuO\rightarrow CuCl_2+H_2\\ \left(15\right)FeCl_2+2AgNO_3\rightarrow2AgCl\downarrow+Fe\left(NO_3\right)_2\\ \left(16\right)CuCl_2+2AgNO_3\rightarrow2AgCl\downarrow+Cu\left(NO_3\right)_2\)

a)
\(n_{Zn}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
0,25-->0,25------------->0,25
=> VH2 = 0,25.22,4 = 5,6 (l)
b) \(C_{M\left(dd.H_2SO_4\right)}=\dfrac{0,25}{0,3}=\dfrac{5}{6}M\)
c) \(n_{Fe_2O_3}=\dfrac{32}{160}=0,2\left(mol\right)\)
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,25}{3}\) => Fe2O3 dư, H2 hết
PTHH: Fe2O3 + 3H2 --to--> 2Fe + 3H2O
\(\dfrac{0,25}{3}\) <--0,25----->\(\dfrac{0,5}{3}\)
=> \(m=32-\dfrac{0,25}{3}.160+\dfrac{0,5}{3}.56=28\left(g\right)\)
PTHH: \(Zn+H_2SO_4\rightarrow ZnSO_4+H_2\)
đb: 0,25
a) số mol của Zn là: \(n_{Zn}=\dfrac{m_{Zn}}{M_{Zn}}=\dfrac{16,25}{65}=0,25\left(mol\right)\)
Theo PTHH, ta có: \(n_{H_2}=\dfrac{0,25\cdot1}{1}=0,25\left(mol\right)\)
Thể tích của H2 ở đktc là: \(V_{H_2\left(đktc\right)}=n_{H_2}\cdot22,4=0,25\cdot22,4=5,6\left(l\right)\)
2 câu còn lại mk chịu

a) 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
b) \(n_{H_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: 2Al + 3H2SO4 --> Al2(SO4)3 + 3H2
0,2<----0,3<-----------------0,3
=> mAl = 0,2.27 = 5,4 (g)
c) \(m_{dd.H_2SO_4}=\dfrac{0,3.98}{30\%}=98\left(g\right)\)

\(n_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
0,2<-----------------------0,2
=> \(n_{Ag}=\dfrac{22-0,2.56}{108}=0,1\left(mol\right)\)
=> \(\%n_{Ag}=\dfrac{0,1}{0,1+0,2}.100\%=33,33\%\)