Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

nFe = 16.8/56 = 0.3 (mol)
nO2 = 6.72/22.4 = 0.3 (mol)
2Fe + 3O2 -to-> Fe3O4
0.2___0.3________0.1
mFe dư = ( 0.3 - 0.2 ) * 56 = 5.6 (g)
mFe3O4 = 0.1*232 = 23.2 (g)
a)
3Fe+2O2→Fe3O4
b)
nFe=16,8/56=0,3mol
nO2=6,72/22,4=0,3mol
Ta có: 0,3/3<0,3/2=> O2 dư tính theo Fe
nFe3O4=0,3/3=0,1
mFe3O4=0,1.232=23,2g

Zn+2HCl->ZnCl2+H2
0,05--------------------0,05
CuO+H2-to>Cu+H2O
0,05----0,05
n Zn=\(\dfrac{3,25}{65}=0,05mol\)
=>n CuO=\(\dfrac{6}{80}=0,075mol\)
=>CuO dư
=>m Cu=0,05.64=3,2g
=>m CuO dư=0,025.80=2g
\(a,PTHH:\\ Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\left(1\right)\\ CuO+H_2\underrightarrow{t^o}Cu+H_2O\left(2\right)\\ b,n_{Zn}=\dfrac{3,25}{65}=0,05\left(mol\right)\\ Theo.pt\left(1\right):n_{H_2}=n_{Zn}=0,05\left(mol\right)\\ n_{CuO}=\dfrac{6}{80}=0,075\left(mol\right)\\ LTL.pt\left(2\right):0,075>0,05\Rightarrow CuO,dư\\ Theo.pt\left(2\right):n_{Cu}=n_{CuO\left(pư\right)}=n_{H_2}=0,05\left(mol\right)\\ m_{Cu}=0,05.64=3,2\left(g\right)\\ c,m_{CuO\left(dư\right)}=\left(0,075-0,05\right).80=2\left(g\right)\)

a)
\(3Fe + 2O_2 \xrightarrow{t^o} Fe_3O_4\)
b)
Ta có :
\(n_{Fe} = \dfrac{8,4}{56} = 0,15(mol)\\ n_{O_2} = \dfrac{96}{32} = 3(mol)\)
Ta thấy : \(\dfrac{n_{Fe}}{3} = 0,05 < \dfrac{n_{O_2}}{2} = 1,5\) do đó O2 dư.
Theo PTHH :
\(n_{O_2\ pư} = \dfrac{2}{3}n_{Fe} = 0,1(mol)\\ \Rightarrow n_{O_2\ dư} = 3 - 0,1 = 2,9(mol)\\ \Rightarrow m_{O_2\ dư} = 92,8(gam)\)
c)
\(n_{Fe_3O_4} = \dfrac{1}{3}n_{Fe} = 0,05(mol)\\ \Rightarrow m_{Fe_3O_4} = 0,05.232 = 11,6(gam)\)
\(a)PTHH:FeCl_3+2O_2\xrightarrow[]{t^o}Fe_3O_4\)
mol 1 2 1
mol
\(b)\)Số mol \(FeCl_3\) là: \(n_{FeCl_3}=\dfrac{m_{FeCl_3}}{M_{FeCl_3}}=\dfrac{8,4}{162,5}=0,052\left(mol\right)\)
Số mol \(O_2\) là: \(n_{O_2}=\dfrac{m_{O_2}}{M_{O_2}}=\dfrac{96}{32}=3\left(mol\right)\)
Lập tỉ lệ: \(\dfrac{1}{0,052}>\dfrac{2}{3}\Rightarrow FeCl_3dư\)
Số mol \(FeCl_3\) phản ứng là:
Từ PTHH\(\Rightarrow\) \(n_{FeCl_3}=\dfrac{0,052\times3}{3}=0,035\left(mol\right)\)
Số mol \(FeCl_3\) dư là: \(n_{FeCl_3dư}=n_{FeCl_3đầu}-n_{FeCl_3p/ứng}=0,052-0,035=0,018\left(mol\right)\)
Khối lượng \(FeCl_3\) dư là: \(m_{FeCl_3dư}=n_{FeCl_3dư}\times M_{FeCl_3}=0,018\times162,5=2,925\left(g\right)\)

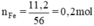
Phương trình hóa học của phản ứng:
Fe2O3 + 3H2 → 2Fe + 3H2O.
Khử 1 mol Fe2O3 cho 2 mol Fe.
x mol Fe2O3 → 0,2 mol.
x = 0,2 : 2 =0,1 mol.
m = 0,1 .160 =16g.
Khử 1 mol Fe2O3 cần 3 mol H2.
Vậy khử 0,1 mol Fe2O3 cần 0,3 mol H2.
V= 0,3 .22.4 = 6,72l.

a.b.
\(n_{Na}=\dfrac{13,8}{23}=0,6mol\)
\(2Na+2H_2O\rightarrow2NaOH+H_2\)
0,6 0,3 ( mol )
\(V_{H_2}=0,3.22,4=6,72l\)
c.\(n_{CuO}=\dfrac{12}{80}=0,15mol\)
\(CuO+H_2\rightarrow\left(t^o\right)Cu+H_2O\)
0,15 < 0,3 ( mol )
0,15 0,15 ( mol )
Chất dư là H2
\(m_{H_2}=\left(0,3-0,15\right).2=0,3g\)

Câu 1:
a, Thí nghiệm 1:
\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\)
Thí nghiệm 2:
\(3H_2+Fe_2O_3\underrightarrow{^{t^o}}2Fe+3H_2O\)
b, Ta có:
\(n_{Mg}=\frac{13,44}{24}=0,56\left(mol\right)\)
\(\Rightarrow n_{H2}=n_{MgSO4}=n_{Mg}=0,56\left(mol\right)\)
\(\Rightarrow V_{H2}=0,56.22,4=12,544\left(l\right)\)
\(\Rightarrow m_{MgSO4}=0,56.120=67,2\left(g\right)\)
c,\(n_{Fe2O3}=\frac{1}{3}n_{H2}=\frac{1}{3}.0,56=\frac{14}{75}\left(mol\right)\)
\(\Rightarrow m_{Fe2O3}=\frac{14}{75}.160=\frac{448}{15}\left(g\right)\)
Câu 2:
d,
\(Zn+2HCl\rightarrow ZnCl_2+H_2\left(1\right)\)
\(Fe_3O_4+4H_2\underrightarrow{^{t^o}}3Fe+4H_2O\left(2\right)\)
e, Ta có:
\(n_{H2}=\frac{5,376}{22,4}=0,24\left(mol\right)\)
Theo PTHH1:
\(n_{HCl}=2n_{H2}=0,48\left(mol\right)\)
\(\Rightarrow m_{HCl}=0,4.36,5=17,52\left(g\right)\)
\(n_{ZnCl2}=n_{H2}=0,24\left(mol\right)\)
\(\Rightarrow m_{ZnCl2}=0,24.136=32,64\left(g\right)\)
f, Theo PTHH2:
\(n_{Fe3O4}=\frac{1}{4}n_{H2}=0,06\left(mol\right)\)
\(\Rightarrow m_{Fe3O4}=0,06.232=13,92\left(g\right)\)

a, \(n_{Fe}=\dfrac{11,2}{56}=0,2\left(mol\right)\)
\(n_{H_2SO_4}=\dfrac{29,4}{98}=0,3\left(mol\right)\)
PT: \(Fe+H_2SO_4\rightarrow FeSO_4+H_2\)
Xét tỉ lệ: \(\dfrac{0,2}{1}< \dfrac{0,3}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{H_2SO_4\left(pư\right)}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2SO_4\left(dư\right)}=0,3-0,2=0,1\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,1.98=9,8\left(g\right)\)
b, \(n_{H_2}=n_{Fe}=0,2\left(mol\right)\Rightarrow n_{H_2}=0,2.22,4=4,48\left(l\right)\)
c, \(n_{CuO}=\dfrac{24}{80}=0,3\left(mol\right)\)
PT: \(CuO+H_2\underrightarrow{t^o}Cu+H_2O\)
Xét tỉ lệ: \(\dfrac{0,3}{1}>\dfrac{0,2}{1}\), ta được CuO dư.
Theo PT: \(n_{Cu}=n_{H_2}=0,2\left(mol\right)\Rightarrow m_{Cu}=0,2.64=12,8\left(g\right)\)

4H2+Fe3O4-to>3Fe+4H2O
nH2=4,48\22,4=0,2 mol
nFe3O4=23,3\232=0,1 mol
=>Fe3O4 du2
=>mFe3O4=0,05 .232=11,6g
=>mH2O=0,2.18=3,6g